下列反应中必须加入还原剂才能进行的是
| A.Cl2→Cl- | B.Zn→ Zn2+ | C.H2→H2O | D.CuO→CuCl2 |
类推是学习和研究的重要思维方法。下列类推结论正确的是
| 化学事实 |
类推结论 |
|
| A |
Al在O2中燃烧生成Al2O3 |
Fe在O2中燃烧也生成Fe2O3 |
| B |
pH=3的盐酸稀释1000倍后pH=6 |
pH=6的盐酸稀释1000倍后pH=9 |
| C |
用电解熔融MgCl2的方法冶炼金属镁 |
用电解熔融NaCl的方法制取金属钠 |
| D |
将SO2通入BaCl2溶液中无沉淀生成 |
将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是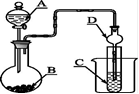
| A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 |
| B.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 |
| C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 |
| D.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 |
将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为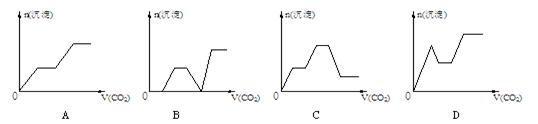
向Fe2O3、CuO、Fe、Cu的混和粉末中加入过量的稀硫酸,充分反应后,仍有红色粉末存在,则关于溶液中阳离子的判断正确的是
| A.只有Fe2+和Cu2+ | B.一定有Fe2+、Cu2+,可能有Fe3+ |
| C.一定有Fe2+,可能有Cu2+ | D.只有Fe2+ |
向一定量的FeO、Fe、Fe2O3的混合物中加入100ml1mol/L的盐酸,恰好使混合物完全溶解,放出224ml标况下的气体,在所得溶液中滴入硫氰化钾溶液无血红色出现(即无3价铁)。若用足量CO在高温下还原同质量的此混合物,能得到铁的质量是
| A.11.2g | B.5.6g | C.2.8g | D.无法计算 |