工业上冶炼金属钼的化学原理为:
①2MoS2+7O2 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O = (NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl = H2MoO4↓+2NH4Cl;
④H2MoO4 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
| A.上述①③⑤属于氧化还原反应,②④属于非氧化还原反应 |
| B.MoO3是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2 |
下列物质与酸雨的形成无关的是
A.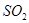 |
B.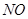 |
C. |
D.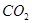 |
某无色溶液中含有K+,Cl-,OH-,SO32-,SO42-,为了检验除OH-外的其它所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象: 下列有关结论错误的是()
下列有关结论错误的是()
| A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl |
| B.现象3中白色沉淀是BaSO4 |
| C.试剂②是盐酸,试剂③是硝酸 |
| D.产生现象2的离子方程式是:Br2+2H2O+SO2=4H++2Br-+SO42- |
下列有关叙述正确的是 ()
| A.氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
下列说法中正确的是( )
| A.30~40 min间该反应使用了催化剂 |
| B.反应方程式中的x=1,正反应为吸热反应 |
| C.30 min时降低温度,40 min时升高温度 |
| D.8 min前A的平均反应速率为0.08 mol·L-1·min-1 |
下列说法错误的是 ()
A.2,3—二甲基—4—乙基己烷的名称是正确的 |
B.如图为对—二甲苯,结构中核磁共振氢谱出现两组峰,其氢原子数之比为 3:2 |
| C.木质素的一种单体结构简式如右图所示每摩尔该物质最多能消耗3molBr2 |
D.合成顺丁橡胶( )的单体是CH2=CH—CH=CH2 )的单体是CH2=CH—CH=CH2 |