已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3
溶液。加入KIO3和析出I2的物质的量的关系曲线如下图所示。下列说法不正确的是
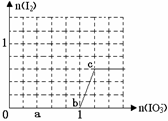
| A.0~b间反应:3HSO3-+ IO3-= 3SO42-+ I-+ 3H+ |
| B.a点时消耗NaHSO3的物质的量为1.2 mol |
| C.b~c间反应:I2仅是氧化产物 |
| D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的KIO3 为1.08mol |
2013年2月15日早晨,一块陨石坠落在俄罗斯乌拉尔山脉地区,引发爆炸,造成1 000余人受伤,专家化验陨石碎片含铁10%。下列有关铁及其化合物的叙述中正确的是( )
| A.1 mol Fe分别与足量的盐酸或氯气反应电子转移数相等 |
| B.水蒸气与铁在常温下反应生成Fe3O4和H2 |
| C.Fe2O3和Al2O3都能溶解于NaOH溶液中 |
| D.生铁中的含碳量高于钢中的含碳量 |
下列过程中,没有明显实验现象的是( )
| A.向Fe(NO3)2溶液中滴加稀硫酸 |
| B.将HCl通入NaAlO2溶液中 |
| C.加热溶有SO2的品红溶液 |
| D.向碳酸氢钠溶液中滴加氢氧化钠溶液 |
下列物质的转化在给定条件下能实现的是( )
①Al2O3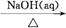 NaAlO2(aq)
NaAlO2(aq)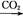 Al(OH)3
Al(OH)3
②S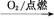 SO3
SO3 H2SO4
H2SO4
③Fe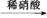 Fe2+
Fe2+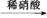 Fe3+
Fe3+
④Fe2O3 FeCl3(aq)
FeCl3(aq)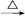 无水FeCl3
无水FeCl3
⑤MgCl2(aq)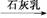 Mg(OH)2
Mg(OH)2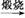 MgO
MgO
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
下列有关烟花爆竹说法中合理的是( )
| A.绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物 |
| B.燃放烟花爆竹时的主要污染物是CO、CO2、SO2、烟尘等物质 |
| C.燃放烟花爆竹时只发生了化学变化,没有物理变化 |
| D.为了保证燃放烟花爆竹时的空气质量,应该同时进行人工降雨除掉污染物 |
下图中,A是正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
A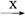 B
B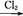 C
C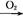 D
D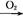 E
E F
F
下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B与Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质