下列实验的操作、现象、结论均正确的是
| 选项 |
操作 |
结论 |
| A |
用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 |
该硫酸盐一定含Na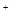 一定不含K 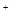 |
| B |
二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 |
酸性条件下NO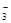 具有强氧化性 具有强氧化性 |
| C |
在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 |
淀粉没有发生水解 |
| D |
某试样溶液中加入少量稀盐酸,有白色沉淀生成 |
试样中一定含有Ag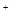 |
下列各组物质中,Y既能与X反应又能与Z反应的是
| 编号 |
X |
Y |
Z |
| ① |
N2 |
Mg |
CO2 |
| ② |
FeCl3溶液 |
Cu |
浓硝酸 |
| ③ |
氨水 |
Al(OH)3 |
稀硫酸 |
| ④ |
KOH溶液 |
SiO2 |
盐酸 |
A.①②B.①④C.①②③D.①②④
某生配制480ml 0.1mol/L的NaOH溶液,下列操作可使所配制的溶液的浓度偏大的是
| A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 |
| B.移液时,有少量液体溅出 |
| C.定容时,俯视刻度线 |
| D.定容摇匀后发现液面下降,继续加水至刻度线 |
由铝屑、盐酸、氢氧化钠溶液反应制取1mol Al(OH)3,至少需要消耗HCl和NaOH的物质的量为
| A.0.25mol,0.25mol | B.0.75mol,0.75mol |
| C.1mol,1mol | D.3mol,3mol |
经氯气消毒的自来水,用以配制以下溶液,不会使溶液变质的是
| A.AgNO3溶液 | B.FeCl2溶液 | C.Na2CO3溶液 | D.NaCl溶液 |
实验是化学的基础。下列说法正确的是
| A.过氧化钠、氯水、浓硝酸通常都要密封保存于棕色试剂瓶中 |
| B.盛溴的试剂瓶里加少量水以减少溴的挥发 |
| C.钾、钠、白磷都应保存在水中 |
| D.做焰色反应实验时所用铂丝,每次用完后用稀硫酸洗涤后再使用 |