硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
I、酸性条件下,锡在水溶液中有Sn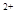 、Sn
、Sn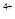 两种主要存在形式,Sn
两种主要存在形式,Sn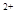 易被氧化。
易被氧化。
Ⅱ、SnCl2易水解生成碱式氯化亚锡[Sn(OH)C1]。
回答下列问题:
(1)操作1的步骤为 、 、过滤、洗涤、干燥。对沉淀进行洗涤的方法是 。
(2)SnCl2粉末需加浓盐酸进行溶解,请结合必要的化学方程式及化学反应原理解释原因: 。
(3)加入Sn粉的作用有两个:①调节溶液pH;② 。
(4)SnSO4还可在酸性条件下用作双氧水的去除剂,发生反应的离子方程式是: 。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):取质量为m的锡粉溶于稀硫酸中,向生成的SnSO4中加入过量的Fe2(SO4)3溶液,用物质的量浓度为c的K2Cr2O7标准溶液滴定生成的Fe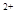 (已知酸性环境下Cr2O
(已知酸性环境下Cr2O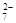 可被还原为Cr
可被还原为Cr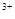 ),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是 。(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)
),共用去K2Cr2O7溶液的体积为V。则锡粉中锡的质量分数是 。(Sn的摩尔质量为M,用含m、c、V、M的代数式表示)
用18 mol·L-1浓硫酸配制100 mL 3.0 mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸③溶解 ④转移、洗涤 ⑤定容、摇匀完成下列问题:
(1)所需浓硫酸的体积是________,量取浓硫酸所用的量筒的规格是________
(从下列中选用A.10 mL B.25 mL C.50 mL D.100 mL)。
(2)第③步实验的操作是__________________________。
(3)第⑤步实验的操作是________________。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中___________________
B.容量瓶用蒸馏洗涤后残留有少量的水________________
C.所用过的烧杯、玻璃棒未洗涤________________
D.定容时俯视刻度线________________
实验室中可用盐酸滴定的方法测定Na2CO3或NaHCO3的含量。测定Na2CO3时,若用酚酞作指示剂,逐滴加入盐酸至溶液由红色变无色时Na2CO3完全转化为NaHCO3;测定NaHCO3时,若用甲基橙作指示剂,逐滴加入盐酸至溶液由黄色变橙色时NaHCO3完全转化为CO2逸出。(化学式量:Na2CO3-106,NaHCO3-84)
(1)分别写出上述转化反应的离子方程式:
________ ____、_____________。
(2)某天然碱的化学式为xNa2CO3·NaHCO3·2H2O,为了测定其组成,取0.3320 g样品于锥形瓶中,加适量蒸馏水使之溶解,加入几滴酚酞,用0.1000 mol·L-1的盐酸滴定至溶液由红色变无色,消耗盐酸20.00mL;再向已变无色的溶液中加入几滴甲基橙,继续用该盐酸滴定至溶液由黄色变橙色,又消耗盐酸30.00mL。
①实验时用到的玻璃仪器有烧杯、胶头滴管、锥形瓶、____________。
②该天然碱化学式中x=_________。
(3)某学习小组在实验室中制备Na2CO3,假设产品中含有少量NaCl、NaHCO3杂质,设计实验方案进行检验,完成下表。
限选试剂:0.1000 mol·L-1盐酸、稀硝酸、AgNO3溶液、酚酞、甲基橙、蒸馏水
| 实验步骤 |
结果分析 |
| 步骤1:取少量样品于试管中,加入适量蒸馏水使之溶解,_____________________。 |
有白色沉淀生成,说明产品中含有NaCl。 |
| 步骤2:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000 mol·L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积V1。 _____________________,记录消耗盐酸的体积V2。 |
____________, 说明产品中含有NaHCO3。 |
某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 |
黑色粉末逐渐溶解,有无色气体逸出。 |
| ② |
向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 |
溶液未出现血红色 |
(1)由上述实验现象推断,黑色粉末X的成分中是否一定不含Fe3O4?____(填“是”或“否”)。
(2)实验①中可能发生反应的离子方程是,,。
Ⅱ.定量测定
(3)操作Z是。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。
(4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。
某次实验需用0.4 mol·L-1 NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯次,洗涤后的溶液___________________,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面________________________时,改用___________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,________________;
(6)若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
| A.所用的NaOH中混有少量Na2O |
| B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥 |
| C.配制溶液所用的容量瓶洗净后没有烘干 |
| D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作 |
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
碱式碳酸铜可表示为:xCuCO3·yCu(OH) 2·zH2O,测定碱式碳酸铜组成的方法有多种。(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式;
②试验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):(a)→()()→()()→()()→()()→()()→(l)
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为g,化学式为;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。。