已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3·L-3,MgF2的Ksp为7.4×10-11mol3·L-3。下列说法中正确的是( )
| A.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小 |
| B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小 |
| C.25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力 |
| D.25℃时,饱和Mg(OH)2溶液与0.1mol·L-1NaF溶液等体积混合,能生成MgF2沉淀 |
短周期主族元素X、Y、Z在周期表中的位置如图。下列说法正确的是
| A.Z元素的最高化合价一定大于X元素 |
| B.三种元素原子半径由大到小的顺序一定是Y>X>Z |
| C.若它们的原子最外层电子数之和为11,则X为金属元素 |
| D.若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且原子的最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M4均为直线形的共价化合物 |
| C.W2Z2是既含离子键又含共价键的离子化合物 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键 |
绿色化学是从源头上防止污染产生或将化学过程对环境的负面影响降低到最低限度。不仅化工生产应遵循绿色化学的原则,化学实验也应遵循绿色化学的原则,实现原料和过程的绿色化。下列实验遵循绿色化学原则的是
| A.用过量的氯气进行性质实验 | B.用双氧水代替高锰酸钾制氧气 |
| C.用溴水代替碘水进行萃取实验 | D.用铜粉代替铜丝进行Cu和浓HNO3的反应 |
除去下列物质中的杂质选用的试剂和方法最合理的是
| 物质 |
杂质 |
试剂 |
方法 |
|
| A |
甲烷 |
乙烯 |
溴的四氯化碳溶液 |
洗气 |
| B |
氯化亚铁溶液 |
氯化铁 |
过量铁粉 |
过滤 |
| C |
二氧化硅 |
氧化铝 |
氢氧化钠溶液 |
过滤 |
| D |
乙酸乙酯 |
乙酸 |
饱和碳酸钠溶液 |
蒸馏 |
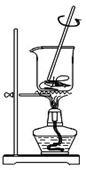
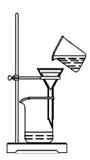
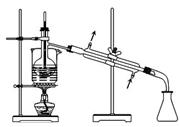
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
 |
 |
 |
 |
| A.将海带灼烧成灰 |
B.过滤得含I-溶液 |
C.萃取后放出碘的CCl4溶液 |
D.分离碘并回收CCl4 |