已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH___0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率______ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。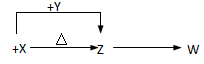
(1)W的电子式是____________ 。
(2)X与Y在溶液中反应的离子方程式是_______________ 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
①装置I中反应的化学方程式是_________ , 装置II中物质的化学式是 ____________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是________ ,所需仪器装置是_________ (从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 ______________。
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 |
K+ Na+ Cu2+Al3+ |
| 阴离子 |
SO42-HCO3-NO3- OH- |
为了鉴别上述化合物.分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)写出B、D的化学式:A,B,C,D,E
(2)在A溶液中加少入量澄清石灰水,其离子方程式为
(3)C常用作
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.则: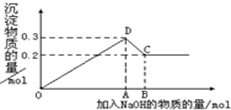
(1)写出代表各线段发生反应的离子方程式:
OD段
DC段
(2)原溶液中Mg2+、Al3+物质的量浓度之比为
(3)图中C点表示当加入molNaOH时,Al3+已经转变为,Mg2+已经转变为.
(4)图中线段OA:AB=
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、H3AsO4、H2O和一种未知物质X.
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是.
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:.
(3)依据(2)的X写出该反应的完整的化学方程式:
(4)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:ASH3>X d.还原性:X>ASH3
在配制物质的量浓度溶液时,下列操作出现的后果是(填“偏低”“偏高”“无影响”):
(1)配制氢氧化钠溶液时,称取已吸潮的氢氧化钠固体______
(2)配制氢氧化钠溶液时,容量瓶内残留少量水______
(3)配制好溶液后,容量瓶未塞好,洒出一些溶液
(4)配制氢氧化钠溶液时,定容时发现液面超过刻度线,立即用吸管吸出少量水,使液面降至刻度线______.