工业制硫酸的第一步反应,可用化学方程式表示如下:4FeS2+11O2=2Fe2O3+8SO2
对此反应下列说法中正确的是()
| A.FeS2既是氧化剂又是还原剂 |
| B.O2只做氧化剂 |
| C.氧化产物只有Fe2O3 |
| D.4molFeS2发生反应时,反应中共有22mol电子转移 |
某学习兴趣小组讨论辨析以下说法,其中说法正确的是
①通过化学变化可以实现16O与18O间的相互转化
②煤的汽化和液化属于物理变化
③潮解、焰色反应、汽油去油污、用CS2清洗管壁上的硫均属于物理变化
④只由一种元素组成的物质一定为纯净物
⑤酸分子中含有几个H,则称为几元酸
⑥H2和D2是同素异形体
⑦白磷应保存在水中;
| A.③⑤⑥ | B.①②⑤ | C.③⑦ | D.①④⑥ |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.lmol 氯气与足量水反应时转移的电子数为NA |
| B.18gD2O中含有10NA个电子 |
| C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| D.lmol 氯气与过量铁反应时转移的电子数为2NA |
随着社会的发展,人们日益重视环境问题,下列说法不正确的是
| A.绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 |
| B.对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 |
| C.采用催化转换技术可将汽车尾气中的NOx和CO转化为无毒气体 |
| D.CO2和SO2是造成酸雨的主要污染物,因此我们要提倡节能减排 |
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,
下列说法中不正确的是
| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2 |
| C.若将上述过程中的KI溶液换为K3[Fe(CN)6]溶液,则有蓝色沉淀生成 |
| D.开始加入的K2Cr2O7为0.25 mol |
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO、SiO、SO、CO、SO中的若干种离子。某同学对该溶液进行了如图实验: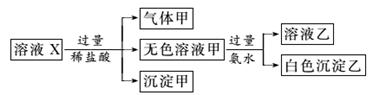
下列判断正确的是