简答题(7分)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),ΔH= -196.6kJ/mol。2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2浓度为 ;
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号) ;
| A.容器内气体的总压强不再发生变化 |
| B.SO2的体积分数不再发生变化 |
| C.容器内气体原子总数不再发生变化 |
| D.相同时间内消耗2nmolSO2的同时消耗nmolO2 |
E.相同时间内消耗2nmolSO2的同时生成nmolO2
原子序数依次增大的X、Y、Z、W四种元素,原子序数均小于36。已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ·mol—1 |
I1 |
I2 |
I3 |
I4 |
| X |
496 |
4562 |
6912 |
9543 |
| Y |
738 |
1451 |
7733 |
10540 |
| Z |
578 |
1817 |
2745 |
11578 |
(1)X、Y、Z的电负性从大到小的顺序为(用元素符号表示),元素Y的第一电离能大于Z的原因是。
(2)W元素应用广泛,是一种重要的生物金属元素,如人体内W元素的含量偏低,则会影响O2在体内的正常运输。已知W2+与KCN溶液反应得W(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物,其配离子结构如图所示。
①W元素基态原子价电子排布式为。
②已知CN—与分子互为等电子体,1molCN—中 键数目为。
键数目为。
③上述沉淀溶解过程的化学方程式为。
利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为: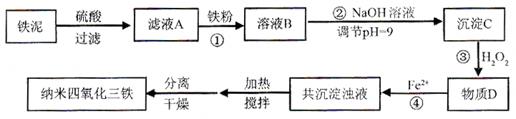
请回答:
(1)过程①主要反应的离子方程式为。
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39。
当溶液中某离子浓度不高于1×10-5 mol·L-1时,可以认为该离子已经完全沉淀。通过计算所得数据说明过程②调节pH=9的原因是。
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56∶1∶32,则过程③主要反应的化学方程式为。
(4)已知Fe2+在弱碱性溶液中还原性较强,图11是研究过程④的实验所得,则该反应所需的时间控制在小时左右,较为适宜。
(5)某工厂处理废铁泥(测得铁元素含量为16.8 %)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时。如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为千克。
过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。
(1)据报道以硼氢化合物NaBH4(B的化合价为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图7所示。该电池放电时正极的电极反应式为:;以MnO2做正极材料,可能是因为。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。
已知:N2H4(g) + O2(g) = N2(g) + 2H2O(g)△H =" –" 534 kJ·mol—1
H2O2(l) = H2O(l) + 1/2O2(g)△H =" –" 98.64 kJ·mol—1
H2O(l) = H2O(g)△H=" +" 44kJ·mol—1
反应N2H4(g) + 2H2O2(l) = N2(g) + 4H2O(g) 的△H=。
(3)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得。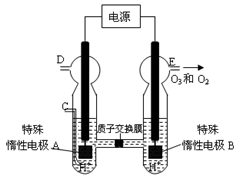
①图中阴极为(填“A”或“B”)。
②若C处通入O 2,则A极的电极反应式为:。
③若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下),则E处收集的气体中O3所占的体积分数为(忽略O 3 的分解)。 (4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+ O3 (g) NO2(g)+ O2 (g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图(如图9)所示。由图可得出的正确说法是
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.Δt1=Δt2时,NO的转化率:a~b段小于b~c段
工业合成有机物F路线如下: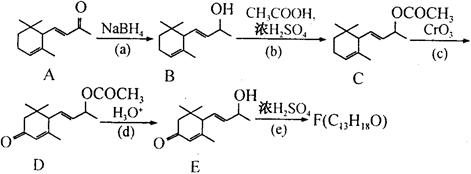
(1)有机物D中含氧的官能团名称为和。
(2)化合物F的结构简式是。
(3)在上述转化关系中,设计步骤(b)和(d)的目的是。
(4)写出步骤(d)的化学反应方程式。
(5)写出同时满足下列条件的D的一种同分异构体的结构简式。
| A.属于芳香化合物 | B.核磁共振氢谱有四个峰 |
| C.1mol该物质最多可以消耗2molNaOH | D.能发生银镜反应 |
(6)已知: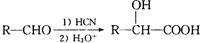 ,写出以乙醇和
,写出以乙醇和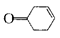 为原料制备
为原料制备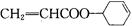 的合成路线图(无机试剂任选)。合成路线流程图示例如下:
的合成路线图(无机试剂任选)。合成路线流程图示例如下: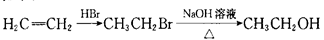
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下: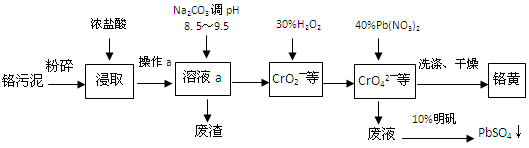
(1)将铬污泥粉碎的目的是。操作a的名称为。
(2)废渣的主要成分是Al(OH)3和Fe(OH)3。已知25℃时,Al(OH)3的Ksp=1.3×10—33,则该温度下反应Al3+ + 3H2O  Al(OH)3 +3H+的平衡常数为。
Al(OH)3 +3H+的平衡常数为。
(3)写出加入30%H2O2过程中发生的离子反应方程式:。
(4)加入Pb(NO3)2沉淀CrO42—时,检验沉淀是否完全的方法是。
(5)在废液中加入10%明矾溶液发生反应的化学方程式为。