下表中,所用仪器与实验目的不相符的是
| 选项 |
仪器 |
实验目的 |
| A |
分液漏斗 |
分离互不混溶的液体 |
| B |
普通漏斗 |
分离固体与液体 |
| C |
天平 |
称量一定质量的固体 |
| D |
烧杯 |
准确量取一定体积的液体 |
下列说法正确的是
| A.需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀 |
| B.在Fe(OH)3胶体中滴加稀硫酸的现象为:先沉淀后溶解 |
| C.用氯化铁溶液和沸水反应制取氢氧化铁胶体:Fe3++3H2O(沸水)===Fe(OH)3↓+3H+ |
| D.在Fe(OH)3胶体中插入两电极通电,在阳极附近颜色加深 |
下列说法正确的是
| A.根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 |
| B.CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物 |
| C.Na2O的水溶液能导电,所以Na2O是电解质 |
| D.在熔化状态下能导电的化合物为离子化合物 |
下列根据实验操作和现象所得出的结论正确的是
| 实验操作 |
实验现象 |
结论 |
|
| A |
淀粉与稀H2SO4共热,再加银 氨溶液水浴加热 |
无银镜生成 |
淀粉水解产物无还原性 |
| B |
向某溶液中先滴加氯水,再滴 加少量KSCN溶液 |
溶液变成血红色 |
溶液中含有Fe2+ |
| C |
向NaAlO2溶液中滴加饱和NaHCO3溶液 |
有白色沉淀产生 |
验证两者都发生了水解反应,且相互促进 |
| D |
将CO2通入Na2SiO3溶液中 |
有白色沉淀生成 |
证明H2CO3酸性比H2SiO3强 |
铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O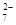 还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(
还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物( )。处理含1 mol Cr2O
)。处理含1 mol Cr2O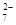 废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是
| A.x=0.5,a=10 | B.x=1,a=5 | C.x=2,a=10 | D.x=0.5,a=8 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是
| A.线段BC代表Fe3+ 物质的量的变化情况 |
| B.原混合溶液中n(FeBr2)=6mol |
| C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+): n(I-): n(Br-)=2:1:3 |