(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) ="=" CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) ="=" CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) ="=" CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g)="=" H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) ="=" CO2(g) + H2(g)的反应热______kJ·mol-1
(2)830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g)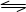 CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题:
①若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= .
②在相同温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是
③若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”)。
在一定条件下,可逆反应mA+nB pC达到平衡,根据以下要求填空:
pC达到平衡,根据以下要求填空:
(1)A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是_______
______________________________________________。
(2)A、C是气体,增加B的量,平衡不移动,则B为_____________________________态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡向____________移动。
2SO2(g)+O2(g) 2SO3(g)反应在一体积可变的密闭容器中进行,试完成下列问题:
2SO3(g)反应在一体积可变的密闭容器中进行,试完成下列问题:
(1)将容器的体积缩小一半,其正反应速率______________,逆反应速率_____________。(填“增大”“减小”或“不变”,以下同)。
(2)保持体积不变,充入N2使体系压强增大,其逆反应速率_________________________。
(3)保持压强不变,充入N2使容器的体积增大,其正反应速率_______________________。
2SO2+O2 2SO3的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O含量______________(填“增加”“减少”或“不移动”),其原因是____________________。
2SO3的平衡体系中,加入由18O构成的氧气,当平衡发生移动后,SO2中18O含量______________(填“增加”“减少”或“不移动”),其原因是____________________。
在恒温、恒容的密闭容器中发生反应:N2O4(g)====2NO2(g)。
(1)20 s内N2O4的浓度由0.1 mol·L-1降至0.06 mol·L-1,则v(NO2)="_______________" mol·(L·min)-1。
(2)若使N2O4的浓度继续由0.06 mol·L-1降至0.036 mol·L-1,若近似用(1)所求得的反应速率计算,后一段反应所需的时间t1为____________ s。
(3)后一段反应实际消耗时间t2____________t1(填“=”“<”或“>”)。
取a mol A和b mol B置于V L容器内,发生可逆反应:a A(g)+bB(g) cC(g)+dD(g),1 min后,测得A的浓度为x mol·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为____________________________________________________________________。
cC(g)+dD(g),1 min后,测得A的浓度为x mol·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为____________________________________________________________________。