已知热化学方程式:
①H2(g)+  O2(g)===H2O(g);ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g);ΔH=-241.8 kJ·mol-1
②2H2(g)+O2(g)===2H2O(g) ;ΔH=-483.6 kJ·mol-1
③H2(g)+ O2(g)===H2O(l); ΔH=-285.8 kJ·mol-1
O2(g)===H2O(l); ΔH=-285.8 kJ·mol-1
④2H2(g)+O2(g)===2H2O(l) ;ΔH=-571.6 kJ·mol-1
则氢气的燃烧热为( )
| A.-241.8 kJ·mol-1 | B.-483.6 kJ·mol-1 |
| C.-285.8 kJ·mol-1 | D.-571.6 kJ·mol-1 |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是()



A B C D
根据表中信息判断,下列选项不正确的是()
A.第①组反应的其余产物为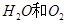 |
B.第②组反应中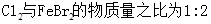 |
C.第③组反应中生成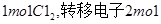 |
D.氧化性由强到弱的顺序为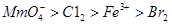 |
工业合成氨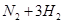

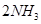 ,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是()
,其正反应为放热反应,如果反应在密闭容器中进行,下列有关说法中正确的是()
| A.该反应使用铁触煤作催化剂,目的是为了增大反应速率,同时提高产率 |
| B.升高温度可以增大正反应速率,同时减小逆反应速率 |
C.达到平衡时,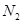 、 、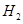 、 、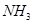 的浓度之比为1:3:2 的浓度之比为1:3:2 |
D.为了提高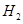 的转化率,可适当提高 的转化率,可适当提高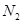 的浓度 的浓度 |
设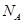 为阿伏加德罗常数的值,下列叙述正确的是()
为阿伏加德罗常数的值,下列叙述正确的是()
A.常温下,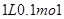 · ·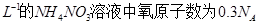 |
B.标准状况下,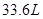 氟化氢中含有氟原子的数目为 氟化氢中含有氟原子的数目为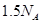 |
C.常温常压下,46g的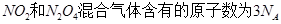 |
D.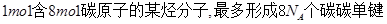 |
将氯气通入一定温度的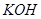 溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移
溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移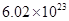 个电子,所得溶液中
个电子,所得溶液中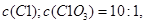 则参与反应的
则参与反应的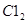 的物质的量为()
的物质的量为()
A.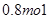 |
B.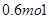 |
C. |
D.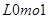 |