下列关于铜电极的叙述不正确的是: ( )
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼铜时粗铜作阳极 |
| C.在镀件上镀铜时可用铜作阳极 |
| D.电解稀硫酸溶液制H2、O2时铜做阳极 |
t℃时,在2L密闭、恒压容器中充入1molA和1molB,发生反应:A(g)+B(g) C(g)。 5min后达到平衡,测得C的物质的量分数为60%,则下列说法正确的是
C(g)。 5min后达到平衡,测得C的物质的量分数为60%,则下列说法正确的是
A.5min内平均反应速率vA=0.15mol·L-1·min-1
B.当同时对原平衡体系升高一定温度和增加一定压强时,达平衡后,C的物质的量分数为60%,则该反应的正反应为放热反应
C.保持其他条件不变,若起始时向容器中加入0.5molA、0.5molB、1.5molC,则反应将向逆反应方向进行
D.t℃,向2L密闭、恒容容器中加入等物质的量的A和B,反应达到平衡状态时,C的物质的量分数仍为60%,则加入A的物质的量为1.6mol
常温下,下列有关叙述正确的是
| A.在0.1mol·L-1Na2C2O4溶液中:2c(Na+)=c(C2O42-)+c(HC2O4—)+c(H2C2O4) |
| B.向10mL pH=12的NaOH溶液中滴加等体积pH=2的CH3COOH溶液:c((CH3COO—)>c(Na+)>c(OH-)>c(H+) |
| C.浓度均为0. 1 mol·L-1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+) =" 2c" (CO32-) + c(OH-) + c(HCO3-) |
| D.浓度均为0. 1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合c(SO42-) =c(Na+)>c(NH4+)>c(H+)>c(OH-) |
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
| A.向溶液中加入酚酞溶液变红,说明该混盐水溶液呈碱性 |
| B.向该混盐中加入稀H2SO4可以产生使品红褪色的气体 |
| C.该混盐在酸性条件下可以产生淡黄色浑浊 |
| D.用玻璃棒蘸取该混盐溶液灼烧,火焰呈黄色,说明溶液中含有Na+ |
化合物C是制备液晶材料的中间体之一,它可由A和B在一定条件下制得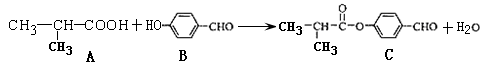
下列说法正确的是
| A.每个A分子中含有1个手性碳原子 |
| B.可以用酸性KMnO4溶液检验B中是否含有醛基 |
| C.1molC分子最多可与4molH2发生加成反应 |
| D.C可发生加成反应、取代反应、氧化反应、消去反应等 |
下列有关说法正确的是
| A.白铁(镀锌铁皮)镀层破损后铁仍不易腐蚀 |
B.CH3Cl(g)+Cl2(g)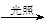 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0 |
| C.MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)< Ksp(MnS) |
| D.合成氨生产中将NH3液化分离,一定能加快正反应速率,提高H2的转化率 |