下列说法中不正确的是( )
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为: Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为: Cu-2e-=Cu2+ |
室温下向10mL pH=3的醋酸溶液中加入10mL水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中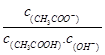 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mlpH=11的NaOH溶液,混合溶液pH=7 |
在pH相同、体积相等的盐酸A和醋酸溶液B中,分别加入等质量的锌,若充分反应后,
有一种溶液中锌有剩余,则正确的判断是
①反应所需时间B>A ②开始时反应速度A>B ③参加反应的锌的质量B>A
④整个反应阶段平均速率B>A ⑤盐酸中锌有剩余 ⑥乙酸溶液中锌有剩余
⑦盐酸中产生氢气多 ⑧乙酸溶液中产生氢气多
| A.③④⑤⑧ | B.①③⑥⑦ | C.①②③⑥ | D.②③④⑤ |
25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所示,有关粒子浓度的关系中,不正确的是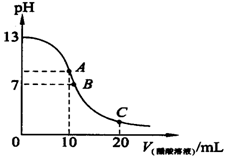
| A.在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+) |
| B.在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+), |
| C.在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-) |
| D.在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+) |
反应SO2(g) + NO2(g)  NO(g) + SO3(g)在一定条件下建立平衡,保持温度和容器体积不变再加入一定量的O2,下列说法正确的是
NO(g) + SO3(g)在一定条件下建立平衡,保持温度和容器体积不变再加入一定量的O2,下列说法正确的是
| A.平衡左移,容器内压强不一定增大 |
| B.平衡右移,达到平衡时容器内压强一定增大 |
| C.平衡右移,SO2的转化率提高 |
| D.平衡不一定移动,容器内压强一定增大 |
下图是425℃时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是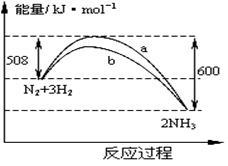
A.该反应的热化学方程式为:N2+3H2 2NH3 △H=-92kJ·mol-1 2NH3 △H=-92kJ·mol-1 |
B.一定条件下N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
| C.加入催化剂,该反应的反应热发生改变 |
| D.温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |