工业制硫酸中的一步重要反应是SO2在400~500 ℃下的催化氧化:2SO2+O2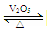 2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法中错误的是( )
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.为了提高SO2的转化率,应适当提高O2的浓度 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
下列溶液一定呈中性的是( )
| A.pH=7的溶液 |
| B.c(H+)=c(OH-)的溶液 |
| C.由强酸、强碱等物质的量反应得到的溶液 |
| D.非电解质溶于水得到的溶液 |
参照反应Br+H2―→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )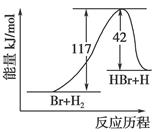
| A.正反应为吸热反应 |
| B.正反应为放热反应 |
| C.加入催化剂,该化学反应的反应热增大 |
| D.从图中可看出,该反应的反应热与反应途径有关 |
可以判定某酸(HA)是强电解质的事实是( )
A.该酸加热至沸腾不分解
B.0.01 mol·L-1该酸的pH=2
C.该酸可以溶解Cu(OH) 2
D.该酸与CaCO3反应放出CO2
对于反应2SO2(g)+O2(g) 2SO3(g),能增大正反应速率的措施是( )
2SO3(g),能增大正反应速率的措施是( )
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO2 | D.降低体系温度 |
为减少汽车对城市大气的污染,近年来中国成功地开发出了以新燃料作能源的“绿色汽车”。这种汽车可避免有毒的有机铅、苯和苯的同系物以及多环芳香烃的排放,保护环境。这种“绿色汽车”的燃料是( )
| A.甲醇 | B.汽油 | C.柴油 | D.重油 |