2.2 g化合物A含有3.01×1022个A分子,则A的相对分子质量为( )
| A.11 | B.22 | C.44 | D.44 g/mol |
下列物质按纯净物、混合物、电解质、非电解质的顺序 组合的一组为
组合的一组为
| A.蒸馏水、氨水、氧化铝、二氧化硫 | B.纯盐酸、空气、硫酸、干冰 |
| C.胆矾、盐酸、铁、碳酸钙 | D.生石灰、漂白粉、氯化铜、碳酸钠 |
.下列叙述正确的是
| A.有单质参加或单质生成的化学反应一定是氧化还原反应 |
| B.生成物只有一种的化学反应不一定是化合反应 |
| C.向煮佛的NaOH溶液中滴加FeCl3溶液可制备Fe(OH)3胶体 |
| D.有电解质参加的化学反应一定可以用离子方程式表示 |
有镁铝混合粉末10.2克,将它溶于500mL 4mol/L的盐酸中,若要使沉淀量最大,则需加入2mol/L的NaOH的体积为
| A.1000mL | B.500mL | C.100mL | D.1500mL |
下列叙述正确的是
| A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中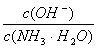 增大 增大 |
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物: |
B.Fe在Cl2中的燃烧产物: |
C.AlCl3溶液中滴加NaOH后铝的存在形式: |
| D.氨水与SO2反应后溶液中的铵盐: |
