相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g)  2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始.平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量a kJ |
| ② |
2 |
3 |
0 |
放出热量b kJ |
| ③ |
2 |
6 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③> ①> ②
C.平衡时氨气的体积分数:①> ③
D.N2的转化率:②> ①> ③
将3.2 g Cu跟30.0 mL 10.0 mol·L-1的HNO3充分反应,还原产物有NO和NO2,若反应后溶液中有a mol H+,则此时溶液中含NO3-的物质的量为
| A.0.5a mol | B.(0.1+a)mol |
| C.0.1a mol | D.2a mol |
下列说法正确的是
| A.SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| B.向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 |
| C.向氯水中加入Na2CO3可使溶液中c(HClO)增大 |
| D.室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变 |
现有如下几个离子方程式①CaCO3+2H+===Ca2++H2O+CO2↑
② 
③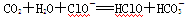
④ ,
,
由此得出的如下结论中不正确的是
A.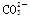 与H+、Ca2+不能大量共存 与H+、Ca2+不能大量共存 |
| B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 |
| D.H2CO3、HClO都属于弱酸 |
下列溶液一定呈中性的是
| A.c(H+)=c(OH-)=10-6 mol·L-1的溶液 |
| B.pH=7的溶液 |
| C.滴入酚酞显无色的溶液 |
| D.酸与碱恰好完全反应生成正盐的溶液 |
短周期主族元素A,B,C,D,E的原子序数依次增大,其中只有C为金属元素,B是地壳中含量最多的元素,C原子的最外层电子数和A相等;C,D两元素原子的质子数之和是A,B两元素质子数之和的3倍,下列叙述正确的是
A.元素的原子半径:A<B<C<D<E
B.对应氢化物的热稳定性:D>E
C.B与C、B与D形成的化合物中化学键类型相同
D.5种元素中最高价氧化物对应的水化物酸性最强的是E