根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
⑴Cl2+2KI=2KCl+I2; ⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,⑷H2S+I2=S+2HI;
| A.S>I2>Fe3+>Cl2 | B.Cl2>Fe3+>I2>S |
| C.Fe3+>Cl2>S>I2 | D.Cl2>I2>Fe3+>S |
下图装置中发生反应的离子方程式为:Zn+2H+→Zn2++H2↑,下列说法错误的是
| A.a,b不可能是同种材料的电极 |
| B.该装置可能是电解池,电解池溶液为稀盐酸 |
| C.该装置可能是原电池,电解质溶液为稀盐酸 |
| D.该装置可看作是铜-锌原电池,电解质溶液时稀硫酸 |
反应A+B→C(△H<0)分两步进行:①A+B→X(△H<0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是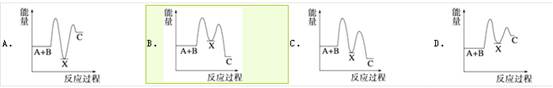
下表中各组物质之间通过一步反应不可能实现如图所示转化关系的是

NO2-既有氧化性,又有还原性。NaNO2大量进入血液时,能将血红蛋白中的Fe2+氧化为Fe3+,正常的血红蛋白转化为高铁血红蛋白,失去携氧功能,引起中毒,甚至死亡。下列各组试剂不能检验NO2-的是
| A.AgNO3 HNO3 | B.FeCl2,KSCN |
| C.KMnO4,H2SO4 | D.KI,淀粉 |
已知:C(s)+H2O(g)→CO(g)+H2(g)△H=a kJ/mol
C(s)+O2(g)→2CO(g)△H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
| A.-332 | B.-118 | C.+350 | D.+130 |