现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为_______ _个。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ g·mol-1。
脱水环化是合成生物碱类天然产物的重要步骤,某生物碱合成路线如图: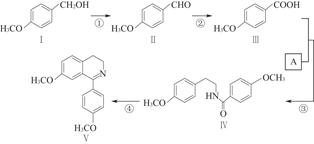
(1)化合物Ⅱ的化学式为。
(2)反应①的化学方程式为(不要求写出反应条件)。
(3)化合物A的结构简式为。
(4)下列说法正确的是。
| A.化合物Ⅱ能发生银镜反应 |
| B.化合物Ⅰ~Ⅴ均属于芳香烃 |
| C.反应③属于酯化反应 |
| D.化合物Ⅱ能与4 mol H2发生加成反应 |
E.化合物Ⅰ、Ⅱ、Ⅲ均能与金属钠反应放出氢气
(5)化合物Ⅵ与化合物Ⅲ互为同分异构体,Ⅵ中含有酯基,且能与FeCl3溶液发生显色反应,其苯环上的一氯代物只有2种。写出一种满足上述条件的Ⅵ的结构简式:。
(6)化合物Ⅶ(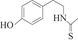 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
对乙酰氨基苯酚F(CH3C—NHOOH)是常用的非甾类消炎解热镇痛药。F可用如下路线来合成:
(1)若A分子的核磁共振氢谱只有一个吸收峰,且能使溴水褪色,则A的结构简式为。
(2)反应①的反应类型是,反应②的反应类型是。
(3)F的同分异构体有多种,写出两种满足下列条件的F的同分异构体的结构简式。
①苯环上有两个取代基;
②苯环上的一卤代物只有两种;
③能发生水解反应,水解产物之一遇FeCl3溶液显色。
、。
(4)F在NaOH溶液中水解的化学方程式为。
(5)D的同分异构体W结构简式为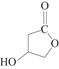 。下列关于W的说法正确的是( )
。下列关于W的说法正确的是( )
a.可与HBr反应生成溴代物
b.可发生消去反应,消去产物有两种
c.1 mol发生催化氧化反应后的产物可与2 mol H2发生加成反应
d.常温下可与Na2CO3溶液反应
H是一种人工合成的香料,其合成路线可简单表示如下: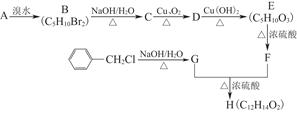
已知A的结构简式为CCH3—CH2CH3CH2,F的分子结构中含有2个甲基。
请回答下列问题:
(1)C中官能团的名称为,G的核磁共振氢谱中有组峰,H的结构简式为。
(2)写出反应D→E的化学方程式:。
E在一定条件下生成的高分子化合物的结构简式为__。
(3)写出符合下列条件的F的3种同分异构体的结构简式:。
①属于酯类②含有1个甲基③能与溴水发生加成反应④能发生银镜反应
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(2)As原子核外M层电子的排布式为________________________________________________________________________。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(4)白磷(P4)的结构如图所示,P原子的轨道杂化方式是________。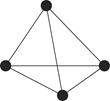
(5)NO可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
①NO的立体构型是________。
②在K3[Co(NO2)6]中,中心离子的配位数为________。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)。
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为________g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。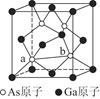
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物。
(1)①H、C、N、O四种元素的电负性由小到大的顺序为____________。
②下列叙述不正确的是________。(填字母)
A.因为HCHO与水分子间能形成氢键,所以CH2O易溶于水
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个σ键和1个大π键,C2H2是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式________。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________________________________________________________________________。
②六氰合亚铁离子[Fe(CN)6]4 -中不存在________。
A.共价键 B.非极性键 C.配位键
D.σ键 E.π键
写出一种与 CN-互为等电子体的单质的分子式________。
(3)根据元素原子的外围电子排布特征,可将周期表分成五个区域,其中Ti属于________区。
(4)一种Al—Fe合金的立体晶胞如图所示。请据此回答下列问题: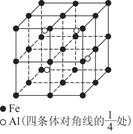
①确定该合金的化学式____________。
②若晶体的密度为ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为__________cm。