体积为V mL,密度为d g/mL,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是( )
| A.m=aV/100d | B.c=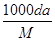 |
C.c= |
D.a%=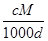 % % |
将10 mL NO和NO2的混合气体通入装满水的倒立在水槽中的量筒里,充分反应后,最后剩余4mL气体,则原混合气体中NO的体积为
| A.1mL | B.3mL | C.5mL | D.7mL |
下列四种有色溶液与SO2气体作用时均能褪色,其实质相同的是
①红色的品红溶液;②紫色的酸性KMnO4溶液;③橙色的溴水;④显红色(含NaOH)的酚酞溶液
| A.①④ | B.②③ | C.①③ | D.②④ |
下列试剂:①浓硫酸、②氯水、③硝酸银、④浓硝酸、⑤浓盐酸、⑥溴化银,其中必须用棕色试剂瓶装的有
| A.①②③④⑤⑥ | B.②③④⑥ | C.②③⑤⑥ | D.①③④⑥ |
在标准状况下,将22.4 L NO2通入过量的NaHCO3溶液中,再使逸出的气体通过装有足量Na2O2颗粒的干燥管,最后收集到的气体是
| A.O2 | B.CO2和O2 | C.NO2和O2 | D.NO |
向50mL 18mol/L H2SO4溶液中加入足量的铜片并加热。充分反应后,被还原的H2SO4的物质的量
| A.小于0.45mol | B.等于0.45mol |
| C.在0.45mol和0.90mol之间 | D.大于0.90mol |