下列实验中,依据实验操作及现象,得出的结论正确的是( )
| |
操 作 |
现 象 |
结 论 |
| A |
取久置的Na2O2粉末,向其中滴加过量的盐酸 |
产生无色气体 |
Na2O2没有变质 |
| B |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化 但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| C |
无色溶液中滴加氯水和CCl4,振荡、静置 |
下层溶液显紫色 |
原溶液中有I- |
| D |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或HCO3- |
室温下,等物质的量浓度的下列溶液中,水的电离程度大小的正确排列顺序是
①NH4Cl②NaCl③KNO3④NaOH
| A.①>④>②=③ | B.④>②=①>③ | C.①>②=③>④ | D.②>③>①>④ |
在一定温度下的某密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g)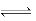 C(g)+D(g)已达平衡状态的是
C(g)+D(g)已达平衡状态的是
| A.混合气体的密度 | B.混合气体的总物质的量 |
| C.混合气体的压强 | D.混合气体的总体积 |
下列说法不正确的是
| A.化学反应中的能量可能以热能的形式表现出来 |
| B.化学反应的热效应数值与参加反应的物质多少有关 |
| C.放热反应不一定需要加热 |
| D.焓变是指1 mol物质参加反应时的能量变化 |
可逆反应2A(g)+3B(g) 2C(g)+D(g)在四种不同条件下的反应速率分别为:
2C(g)+D(g)在四种不同条件下的反应速率分别为:
① (A)="0.5" mol·L—l·min—l②
(A)="0.5" mol·L—l·min—l② (B)="0.6" mol·L—l·min—l
(B)="0.6" mol·L—l·min—l
③ (C)="0.35" mol·L—l·min—l④
(C)="0.35" mol·L—l·min—l④ (D)="0.4" mol·L—l·min—l
(D)="0.4" mol·L—l·min—l
则该反应在不同条件下反应速率最快的是
A.①B.②C.③D.④
能证明某物质是弱电解质的是
| A.难溶于水 |
| B.溶液中存在已电离的离子和未电离的分子 |
| C.水溶液的导电性差 |
| D.熔融状态时不导电 |