下列关于Fe(OH)3胶体的制备,正确的操作是
| A.将FeCl3 溶液滴入蒸馏水中即可 |
| B.将FeCl3 溶液滴入热水中,得到黄色液体即可 |
| C.将FeCl3 溶液滴入沸水中,得到红褐色液体即可 |
| D.将FeCl3 溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |
如图,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法正确的是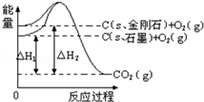
| A.金刚石的稳定性强于石墨 |
| B.12g石墨总键能比12g金刚石小1.9kJ |
| C.石墨和金刚石的转化是物理变化 |
| D.C(s、石墨)=C(s、金刚石)△H="+1.9" kJ/mol |
在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.1mol |
250℃和1.01×105Pa时,反应 2N2O5(g)=4NO2(g)+O2(g);△H=+56.76kJ•mol﹣1,自发进行的原因是
| A.是放热反应 | B.是吸热反应 |
| C.是熵减少的反应 | D.熵增大效应大于焓变效应 |
据报道,科学家开发出了利用太阳能分解水的新型催化剂.下列有关水分解过程的能量变化示意图正确的是
A. |
B. |
C. |
D. |
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B.合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施 |
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
D.对于2HI(g)H 2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深 |