下表是元素周期表的一部分,其中列出了①一⑥六种元素在周期表中的位置。
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
| 2 |
|
|
|
① |
② |
③ |
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
请回答下列问题:
(1)⑤的元素符号为 ,①与③形成的酸性氧化物电子式 。
(2)④和⑦两元素形成的化合物的化学式为 ,焰色反应为 色。
(3)单质⑦制备漂白液的化学方程式 。
(4)④在空气中燃烧的生成物的化学式 ,其颜色是 色。
(5)Cu与②的最高价氧化物的水化物的稀溶液反应的化学方程式 。
、某芳香族化合物A的水溶液呈酸性,测得A分子中无酚羟基。A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。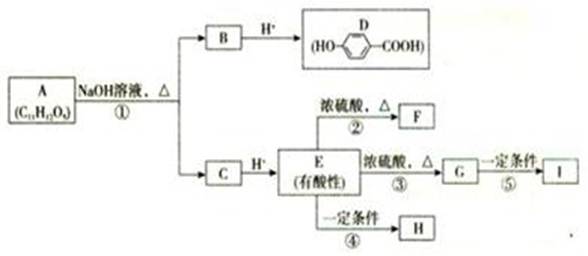
请回答:
(1)E中的官能团名称是羟基、 。
(2)③的反应类型是 。
(3)②的化学方程式是 。
(4)A与H的结构简式分别是 、 。
(5)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 。
(6)写出符合下列条件的G的同分异构体:
①能发生水解反应
②分子中不含环状结构
③核磁共振氢谱显示分子中有4种不同化学环境的氢原子
④能发生银镜反应,分子中有甲基
、A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。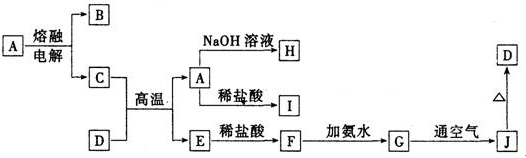
请回答下列问题:
(1)A物质的名称为___________,H与I反应所得难溶物化学式为 。
(2)C与D在高温下的反应在冶金工业上称为 反应
(3)写出G→J、J→D的化学方程式:___ 、 _
(4)A→H的离子方程式为___________________________________________
(5)用离子方程式表示I物质能用于净水的原理______________________
、短周期元素X、Y、Z、W、Q的原子序数依次增大,Y原子最外层电子数是次外层的2倍,X、W可分别与Z组成常见化合物X2Z、X2Z2、W2Z、W2Z2,Q的单质是常见的半导体材料。请回答:
(1)Y在元素周期表中的位置是 。
(2)X2Z的电子式是 。
(3)W2Z2与X2Z反应的化学方程式是 。
(4)上述元素中有两种非金属元素位于同一主族。能证明它们非金属性强弱的一个反应的化学方程式是 。
(5)在 25℃、101 kPa下,Q的气态氢化物在氧气中完全燃烧可得Q的最高价氧化物,反应中每转移1mol e-放热190.0 kJ。则该反应的热化学方程式是 。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示。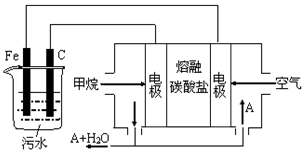
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的__________。
a.H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH。
(2)电解池阳极能同时发生了两个电极反应(阳极上还会产生微量气泡),电极反应式分别是:Ⅰ.___________________________;Ⅱ.___________________________________;
(3)该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。
①负极的电极反应是______________________;
②正极的电极反应是________________________________;
③为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见上图)。A物质的化学式是_________________;
已知某二元酸(化学式用H2RO4表示)在水中的电离方程式为: H2RO4=H++HRO4-;HRO4 H++ RO42-回答下列问题:(1)NaHRO4溶液显(填“酸性”、“中性”或“碱性”),理由是_________
H++ RO42-回答下列问题:(1)NaHRO4溶液显(填“酸性”、“中性”或“碱性”),理由是_________
(用离子方程式和必要的文字说明)。
(2)Na2RO4溶液湿(填“酸性”、“中性”或“碱性”),理由是__________ (用离子方程式表示)
(3)如果25℃时,0.1 mol/L的NaHRO4溶液中,c(RO42-)=0.029 moL/L,则0.1mol/L H2RO4溶液中c(RO42-)0.029 mol/L(填“<”、“>”或“=”),理由是。
(4)25℃时,0.1 mol/L的NaHR04溶液中,各离子浓度由大到小的顺序是。