水在很多的反应中,起到极其重要的作用。根据下面水参与的反应,回答问题:
①2F2+2H2O==4HF+O2
②2Na2O2+2H2O="=" 4NaOH + O2↑
③2Na+2H2O==2NaOH+H2↑
④2H2O 2H2↑+O2↑
2H2↑+O2↑
(1)水只作氧化剂的是 ;(填写序号,下同)水只作还原剂的是 ;水既作氧化剂,又做还原剂的是 ;水既不是氧化剂,又不是还原剂的氧化还原反应是 。
(2)请标出下列反应的电子转移的方向和数目。3Cl2 +6 NaOH=5NaCl + NaClO3 + 3H2O
(3)上述反应3Cl2 + 6NaOH=5NaCl + NaClO3 + 3H2O若转移5mol电子,则所得氧化产物的物质的量为 mol。
某温度(t ℃)时,水的离子积为KW =1×10-13,则该温度____ 25 ℃(选填“>”“<”“=”),其理由是________________________________。若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两溶液的体积比。
(1)若所得混合溶液为中性,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____。(用c(Na+)等表示)
(2)若所得混合液的pH=2,则a∶b =__________;此溶液中各种离子的浓度由大到小的排列顺序是____。(用c(Na+)等表示)
在密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g) 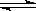 2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g)△H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
(1)升高温度;
(2)加入催化剂;
(3)充入更多的H2 ;
(4)扩大容器的体积;
(5)保持容器容积不变,通入氖气。
发射卫星用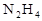 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: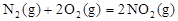 △H1=+67.7kJ/mol
△H1=+67.7kJ/mol
N2H4(g)+O2(g)= N2(g)+2H2O(g)△H2=-534kJ/mol
试写出N2H4与 NO2反应的热化学方程式。
化学键的键能是指气态原子间形成1mol化学键时释放的能量。如:H(g)+I(g)→H-I(g)+297KJ即H-I键的键能为297kJ/mol,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。化学反应的发生可以看成旧化学键的破坏和新化学键的形成。下表是一些键能数据。(单位:kJ/mol)
| 键能 |
键能 |
键能 |
|||
| H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
| S=S |
255 |
H-S |
339 |
C-F |
427 |
| C-Cl |
330 |
C-I |
218 |
H-F |
565 |
| C-O |
347 |
H-O |
464 |
Si—Si |
176 |
| Si—O |
460 |
O=O |
497 |
阅读上述信息,回答下列问题:
(1)根据表中数据判断CCl4的稳定性(填“大于”或“小于”)CF4的稳定性。试预测C-Br键的键能范围_________< C-Br键能 <__________
(2)有人认为:H-O键的键能大于H-S键的键能,所以H2O的熔沸点高于H2S的熔沸点。你是否赞同这种观点?如不赞同,请说出你的解释。
(3)已知H2O(l)=H2O(g) ΔH=+44kJ/mol,请写出表示氢气燃烧热的热化学方程式:
(10分)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: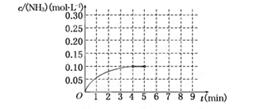
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)为______________.
(2)该反应达到平衡时H2的转化率________.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为____________.(填序号)
A、0.20 mol·L-1 b、0.12 mol·L-1c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时NH3的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(N2)、n(H2)、n(NH3)分别为a、b、c,则a、b、c之间应该满足的关系式为:
(6)若该反应在298K、398K时的化学平衡常数分别为K1、K2,则K1K2(填“>” “="”" 或 “<” )。