某温度下,Kw=10—13,已知该温度下某浓度Na2CO3溶液的pH=10,则该溶液中由水电离的c(OH—)是
| A.1×10—10 mol/L | B.1×10—3 mol/L |
| C.1×10—4 mol/L | D.1×10—7 mol/L |
在溶液中能共存,加入OH-有沉淀析出,加入H+能放出气体的是()
| A.Na+、H+、NO3-、Cl- | B.K+、H+、Cl-、SO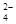 |
| C.Ca2+、NO3-、HCO3-、Cl- | D.Fe3+、NH4+、SCN-、Cl- |
锥形瓶内盛有气体X,滴管内盛有液体y。若挤压滴管胶头,使液体y滴入锥形瓶中,振荡,过一会儿,可见小气球a鼓胀起来。气体X和液体y不可能是( )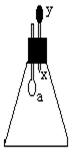
| X |
y |
|
| A |
NH3 |
H2O |
| B |
SO2 |
KOH溶液 |
| C |
CO2 |
6mol∕L H2SO4溶液 |
| D |
HCl |
6mol∕L NaNO3溶液 |
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的( )
| A.将NaHCO3固体加入新制氯水,有无色气泡(H+) |
| B.滴加AgNO3溶液生成白色沉淀(Cl-) |
| C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2) |
| D.使红色布条褪色(HCl) |
由锌、铜、铝、镁四种金属中的两种组成的混合物32.5g,与足量的盐酸反应产生的氢气在标准状况下为11.2L,则混合物中一定含有的金属是()
| A.锌 | B.铜 | C.铝 | D.镁 |
下列各组物质中,因反应条件、用量、浓度等不同而发生不同化学反应的是()
①Cu与硝酸;②SO2与NaOH溶液;③AlCl3溶液与KOH溶液;④CO2与Na2SiO3溶液;
⑤Zn和硫酸;⑥SO2和H2S
| A.除②外 | B.除⑥外 | C.除⑤外 | D.全部 |