对下列实验操作和事实的解释正确的是
| A.某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为Cl2有强氧化性 |
| B.向氯水中加入碳酸氢钠粉末,有气泡产生,说明氯水中含有H+ |
| C.配制一定物质的量浓度的溶液发现浓度偏低,可能由于配制溶液所用的容量瓶事先未干燥 |
| D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)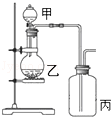
| 选项 |
实验目的 |
甲 |
乙 |
丙 |
| A |
制取并收集NH3 |
浓氨水 |
CaO |
H2O |
| B |
制取并验证碳酸酸性比硅酸强 |
浓盐酸 |
大理石 |
硅酸钠溶液 |
| C |
制取并验证Cl2没有漂白性 |
浓盐酸 |
MnO2 |
干燥的红布条 |
| D |
制取并验证SO2具有漂白性 |
70%硫酸 |
Na2SO3 |
品红试液 |
水溶液中能大量共存的一组离子是
| A.NH4+、Ba2+、Br﹣、CO32﹣ |
| B.Cl﹣、SO32﹣、Fe2+、H+ |
| C.K+、Na+、SO42﹣、MnO4﹣ |
| D.Na+、H+、NO3﹣、HCO3﹣ |
下列表示对应化学反应的离子方程式正确的是
| A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- |
B.向NH4HSO3溶液中加过量的NaOH溶液并加热:NH4++OH-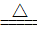 NH3↑+H2O NH3↑+H2O |
| C.将过量SO2通入冷氨水中:SO2+NH3·H2O=HSO3-+NH4+ |
| D.Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的OH-恰好反应一半时:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O |
某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是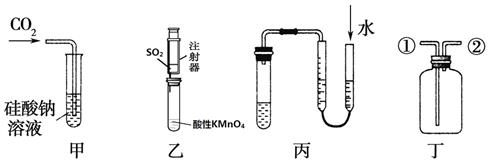
| A.甲装置:可用来证明碳的非金属性比硅强 |
| B.乙装置:可用来探究SO2的漂白性 |
| C.丙装置:用图示的方法可以检查此装置的气密性 |
| D.丁装置:从①口进气可集满二氧化碳,从②口进气,可收集氢气。 |
下列说法错误的是
| A.酸性氧化物不一定能与水反应生成对应的酸,与水反应生成酸的氧化物不一定是酸性氧化物 |
| B.碱性氧化物不一定能与水反应生成对应的碱,与水反应生成碱的氧化物不一定是碱性氧化物 |
| C.SO2、Na2O的水溶液都能导电,所以它们都是电解质 |
| D.在溶于水或熔融状态下能够自身发生电离的化合物一定是电解质 |