现有以下物质:
①NaCl晶体 ②液态HCl ③CaCO3固体 ④熔融KCl
⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
(1)以上物质中能导电的是________。
(2)以上物质中属于电解质的是_______,属于非电解质的是_______。
(3)以上物质中,溶于水且能导电的物质是________。
地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请根据该图回答下列问题: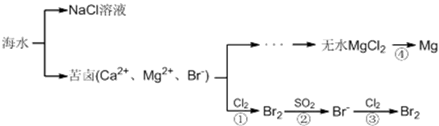
(1)淡化海水的方法有____________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)反应④由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_______________________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的离子方程式_________________再用H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为___________。
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:______________。
(12分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:。若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H=kJ/mol。
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,写出该电池负极的电极反应式:____________________。该电池总反应式:________________________。
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到0.32 g O2,中和电解生成的酸需0.4 mol·L-1 NaOH溶液mL。
CO是一种无色、无味且不溶于水的有毒气体,其制法有:
(1)实验室可用甲酸和浓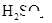 共热制取CO.
共热制取CO.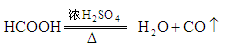
a.甲酸和浓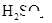 应怎样混合?浓
应怎样混合?浓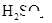 起什么作用
起什么作用
b.请据实验原理选择所需主要玻璃仪器(导管除外)
c.怎样收集CO气体
(2)实验室还可用草酸晶体与浓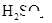 共热制取CO.H2C2O4
共热制取CO.H2C2O4 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
请问:怎样才能得到不含 的CO气体? _________.
的CO气体? _________.
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:________________.在此条件下,C和 的还原性谁强? _________.
的还原性谁强? _________.
塑料电镀是近几十年来发展起来的表面处理新技术,广泛用于电子、家用电器、汽车、建筑等工业。它先是在塑料、陶瓷等非金属表面采用化学沉积的方法沉积出一层金属层,再用电解的方法镀上铜层,电解液为 CuSO4水溶液。
(1)请写出电解时,阴极上可能发生的反应:
①;②。
(2)设通过0.01mol电子后,阴极上沉积出铜 0.2879g , 阴极上还可能放出的气体是。计算标准状况下阴阳极共放出气体的体积。