粉末状试样A是由等物质的量的MgO和Fe2O₃组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20克A全部溶于0. 15L 6mol·L -1的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L气体(标准状况),同时生成溶液D,还有残留固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 ,
产物中的单质B是 。
(2)②中所发生的各反应的化学方程式是 、 。
(3)③中所发生的各反应的离子方程式是 、 。
(4)若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要 ,配制过程中除需用FeCl3固体、蒸馏水外,还需要的试剂有 。将已配制好的溶液滴入沸水中并煮沸一段时间,可得到红褐色液体,该反应的离子方程式为 ,此液体具有的性质是 (填字母)。
a.光束通过该液体时形成光亮的“通路”
b.向该液体中加入AgNO3溶液,无沉淀产生
c.将该液体进行过滤,可得到红褐色固体
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(2)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。
①向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是 (填化学式)。
②已知:3Fe(s)+2O2(g)=Fe3O4(s) △H=−1118 kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) △H=−1675.7 kJ·mol-1
则铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为
。
(1)在298K时,1mol C2H6 在氧气中完全燃烧生成CO2和液态水,放出热量1558.3kJ。写出该反应的热化学方程式 。
(2)利用该反应设计一个燃料电池:用KOH溶液作电解质溶液,多孔石墨作电极,在电极上分别通入乙烷和氧气。通入乙烷气体的电极应为 极(填“正”或“负”),该电极上发生的电极反应式为 。
(3)在右图所示实验装置中,石墨棒上的电极反应式为 。如果起始时盛有1L pH=5的CuSO4溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1,此时可观察到的现象是 。若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入 (填物质名称),其质量约为 。
(4)将普通碳钢钉放入“84消毒液”(NaClO溶液)中浸泡一段时间。预期的实验现象是 。
(5)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,某同学设计了如图所示实验装置,写出碳(C)极上发生的电极反应式 。
(1)铜是人类最早使用的金属之一,以下是冶炼铜的一个反应:
Cu2S+2Cu2O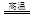 6Cu+SO2
6Cu+SO2
该反应中被氧化的元素是,若反应中转移1mol电子,得到Cumol。
(2)下列两种方法均可以制备CuSO4。
方法一:2Cu+O2 2CuO,CuO+H2SO4=CuSO4+H2O
2CuO,CuO+H2SO4=CuSO4+H2O
方法二:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
①假如某工厂欲生产CuSO4,请选择一种方法,并说明理由:
。
②有同学认为,生成等量的硫酸铜两种方法消耗的能量相同,因为反应都是铜转变为CuSO4,你认为上述说法(填“正确”或“不正确”),原因是
。
重铬酸钾(K2Cr2O7)为用途极广的铬化合物。铬铁矿的主要成分可表示为FeO•Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程
如下图所示:
已知:①K2Cr2O7有强氧化性
②NaFeO2遇水强烈水解
③Cr2O72-+ H2O  2CrO42- + 2H+
2CrO42- + 2H+
请回答:
(1)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(2)滤液1的成分除NaOH、Na2CrO4外,还含有(填化学式) ;
生成滤渣1中红褐色物质的反应离子方程式是 。
(3)由滤液2转化为Na2Cr2O7溶液应加入的试剂是 。
(4)向Na2Cr2O7溶液中加入K2SO4固体,发生复分解反应而制得K2Cr2O7。生成K2Cr2O7晶体的过程是:加热浓缩、降温结晶、过滤、洗涤、干燥。试简述此法能够制得K2Cr2O7晶体的原因是:;
洗涤时应选用 (选填字母)。
| A.蒸馏水 | B.酒精 | C.稀硫酸 | D.饱和K2SO4溶液 |
(5 )工业上常用Fe2+处理酸性K2Cr2O7废水,先将Cr2O72— 转化为Cr3+,该反应的离子方程式为,再调节溶液的pH使金属离子生成沉淀而除去。
A、B、C、D均为中学化学中常见的物质,它们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,则属于短周期的主族金属元素A为 (填元素符号)。
(2)若D是金属单质,D在潮湿的空气中易发生吸氧腐蚀,C溶液在保存时应加入酸和少量D防止其变质,若不加D则C溶液在空气中变质的离子方程式为 ;将D的氯化物的水溶液蒸干并灼烧产物是 。
(3)若A、B、C均为无机化合物,且均含地壳中含量最高的金属元素E,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式 。
(4)将第(1)题推出的A单质与第(3)题E单质的混合物11.9g投入一定量的水中充分反应,A与E均没有剩余,共收集到标准状况下的气体vL。向所得溶液中逐滴加入浓度为2mol•L-1的H2SO4溶液,至100mL时白色沉淀达到最大量。则v= 。