利用100mL0.50mol•L﹣1 Na2CO3溶液配制Na+浓度为0.20mol•L﹣1的溶液,下列操作正确的是
| A.将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
| B.将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌 |
| C.将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌 |
| D.将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,满足图示转化关系的是()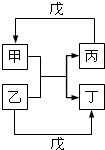
| 物质 选项 |
甲 |
乙 |
丙 |
戊 |
丁 |
| A |
Cu |
HNO3 |
Cu(NO3)2 |
Fe |
NO |
| B |
H2O |
Fe |
H2 |
O2 |
Fe2O3 |
| C |
Al |
NaOH |
H2 |
Al2O3 |
NaAlO2 |
| D |
CH3CHO |
O2 |
CH3COOH |
H2 |
H2O |
下列表示对应化学反应的离子方程式正确的是()
| A.Na2O2溶于水产生O2: 2O22-+2H2O=O2↑+4OH- |
| B.向氨水通入足量SO2:SO2十2NH3·H2O=2NH4++SO32-+H2O |
| C.次氯酸钠与浓盐酸反应产生Cl2:ClO-+Cl-+H2O=Cl2↑+2OH- |
| D.NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O |
设NA为阿伏加德罗常数的值,下列说法中正确的是()
| A.标准状况下,11.2LNO和11.2LSO3的分子总数为0.5NA |
| B.0.1molBr2与足量H2O或NaOH反应转移的电子数均为0.1NA |
| C.0.lmol的白磷(P4)或四氯化碳(CCl4)中所含的共价键数均为0.4NA |
| D.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
关于下列各实验装置的叙述中,不正确的是( )
| A.图①可用于实验室制取少量NH3或O2 |
| B.可用从a处加水的方法检验图②装置的气密性 |
| C.实验室可用图③的方法收集H2或NH3 |
| D.利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜、c为阴离子交换膜 |
下列有关物质性质或用途的说法正确的是()
| A.铜的金属活动性比铁的弱,铜不能与任何强酸发生反应 |
| B.浓硫酸可用作干燥剂是因为其具有强氧化性 |
| C.利用Al2O3制作的坩埚,可用于熔融烧碱 |
| D.制水泥和玻璃都用石灰石作原料 |