铁镍蓄电池,放电时的总反应为: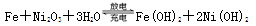 下列有关该电池的说法不正确的是
下列有关该电池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
若 pH="3" 的酸溶液和 pH="11" 的碱溶液等体积混合 后溶液呈酸性,其原因可能()
| A.生成一种强酸弱碱盐 | B.弱酸溶液和强碱溶液 |
| C.强酸与弱碱溶液反应 | D.一元强酸溶液与一元强碱溶液反应 |
化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是()
| A.定性检验 SO32–,将 BaCl2溶液用 HNO3酸化 |
| B.为了提高 KMnO4溶液的氧化能力,用盐酸将其酸化 |
| C.检验某溶液中是否含 Cl–,用 HNO3酸化的 AgNO3溶液 |
| D.配制 FeCl2溶液时通常加少量 HNO3酸化,减小其水解程度 |
已知氟化氢气体存在下列平衡:2H3F3 3H2F2,H2F2 2HF,若平衡时混合气体 的平均摩尔质量为 42g/mol,则 H3F3在平衡混合气中的体积分数为()
| A.小于 10% | B.大于 10% | C.等于 10% | D.大于或等于 10% |
下列关于电解质溶液的叙述中正确的是()
| A.常温下,pH="7" 的 CH3COONa 和 CH3COOH 的混合溶液中离子浓度大小顺序为: c(CH3COOˉ)﹥(Na+)﹥c (H+)="c" (OHˉ) |
| B.将 pH="10" 的氨水稀释后,溶液中所有的离子的浓度均降低 |
| C.中和 pH 与体积均相同的盐酸和醋酸溶液,消耗 NaOH 的物质的量相同 |
| D.常温下,同浓度的 Na2CO3与 NaHCO3溶液相比,Na2CO3溶液的 pH 大 |
下列说法不正确的是
| A.合成氨生产过程中,将 NH3液化分离,可加快正反应速率,提高 N2和 H2的转化率 |
| B.电解饱和食盐水,制烧碱采用离子膜交换法,只允许 Na+由阳极区到阴极区,而阴离子不能通过。 |
| C.电解精炼铜时,同一时间内由阳极溶解铜的质量比阴极析出铜的质量小 |
| D.电镀铜时候,应把铜作阳极 |