实验是化学学习的基础,请完成以下实验填空:
Ⅰ.(1)常压下,已知甲烷的热值是55.625KJ/g,请写出甲烷燃烧热的热化学方程式 。
(2)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。若实验中大约要使用245 mL NaOH溶液,配制0.50 mol/L NaOH溶液时至少需要称量NaOH固体 g。
(3)测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。装置中环形玻璃搅拌棒的搅拌方法是 ,该实验过程中量筒最少要准备 个。
(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的a= ℃
| 温度 实验 次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
30.1 |
a |
| 2 |
27.0 |
27.4 |
27.2 |
31.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
| 4 |
26.4 |
26.2 |
26.3 |
31.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c="4.18" J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
e、配置氢氧化钠溶液的氢氧化钠固体中混有氧化钠
Ⅱ.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是_______________________________;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
 实验 实验混合溶液 |
A |
B |
C |
D |
E |
F |
| 4 mol·L-1 H2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
请完成此实验设计,其中:V1=__________, V9=________;
(3)该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
按要求完成下列问题:
(1)写出下列反应的化学方程式:
①乙烯通入到溴的四氯化碳溶液中:;
②苯与浓硝酸、浓硫酸混和后加热至50℃ ~60℃ 发生反应:。
(2)苯可以和浓硫酸发生取代反应生成苯磺酸( ),根据质量守恒定律,可判断出另一个反应产物为。
),根据质量守恒定律,可判断出另一个反应产物为。
(3)石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照下图进行:
①碎瓷片的作用是。
| A.作反应物 | B.积蓄热量 | C.有催化功能 | D.防止暴沸 |
②将石蜡油分解所得生成物通入到酸性高锰酸钾溶液中,现象是。
如图是以石墨为电极电解CuCl2溶液的装置示意图。
(1)电解过程中能量转化的主要形式是。
(2)电解一段时间后,b电极上可观察到的现象是。
(3)电解过程中,a电极为极,该电极上发生的电极反应式为:,检验该电极产物的方法。
已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为;
(2)所得溶液中Cl-的物质的量为mol;
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=。
将含有C、H、O的有机物3.0g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过装有CaCl2(A)和碱石灰(B)的干燥管,测得A管质量增加了1.8 g,B管质量增加了4.4 g,已知该有机物的相对分子质量为60。(1)燃烧此有机物3.0 g需消耗O2(标准状况)L;(2)求此有机物的分子式。
如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、稀盐酸、锌粒、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题。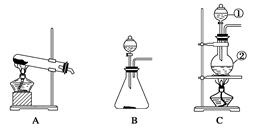
(1)选用A装置可制取的气体有;选用B装置可制取的气体有;通常选用C装置制取的气体有。若用亚硫酸钠和浓硫酸来制取二氧化硫气体应选用装置(填装置的编号字母)。
(2)写出利用上述有关药品制取氯气的化学方程式:。
(3)若要制得干燥的氨气,可选用下列干燥剂中的(填序号)。
A.生石灰 B.浓硫酸 C.五氧化二磷
(4)标号①的仪器除可用于在气体发生装置中添加试剂外,在实验中常用于(填实验操作名称)。