工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)  Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
Si(s)+4HCl(g);ΔH=+Q kJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是
| A.反应过程中,若增大压强能提高SiCl4的转化率 |
| B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ |
| C.反应4 min时,若HCl浓度为0.12 mol·L-1,则H2反应速率为0.03 mol·L-1·min-1 |
| D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol·L-1的NaOH溶液恰好反应 |
已知:
CH3CH2CH2CH3(g)+13/2O2(g) ===4CO2(g)+5H2O(l)ΔH=-2 878 kJ·mol-1
(CH3)2CHCH3(g)+13/2O2(g)===4CO2(g)+5H2O(l)ΔH=-2 869kJ·mol-1
下列说法正确的是
| A.正丁烷分子储存的能量大于异丁烷分子 |
| B.正丁烷的稳定性大于异丁烷 |
| C.异丁烷转化为正丁烷的过程是一个放热过程 |
| D.异丁烷分子中的碳氢键比正丁烷的多 |
已知下列两个热化学方程式
2H2(g) + O2(g) ===2H2O(l)△H = —571.6kJ·mol-1
C3H8(g) +5O2(g) === 3CO2(g) + 4H2O(l)△H = —2 220.0kJ·mol-1
实验测得氢气和丙烷的混和气体共5 mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是
| A.1:3 | B.3:1 | C.1:4 | D.1:1 |
已知热化学方程式:
SO2(g)+1/2O2(g) 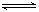 SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为
| A.196.64 kJ | B.196.64 kJ/mol | C.<196.64 kJ | D.>196.64 kJ |
科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的。已知在25℃,105 Pa时,1 mol石墨和1 mol一氧化碳完全燃烧生成二氧化碳时的放热分别是ΔH=-393.5 kJ/mol和ΔH=-283 kJ/mol,下列说法或方程式正确的是
| A.在相同条件下:2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ/mol |
| B.1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ |
| C.在相同条件下,C(石墨,s)+CO2(g)===2CO(g) ΔH=+172.5 kJ/mol |
| D.已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)="=" SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)="=" SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰) Sn(s,白) ΔH3 =" +2.1" kJ·mol-1
Sn(s,白) ΔH3 =" +2.1" kJ·mol-1
下列说法正确的是
| A.ΔH1>ΔH2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |