合成氨是人类科学技术上的一项重大突破。
(1)NH3经一系列反应可以得到HNO3和NH4NO3。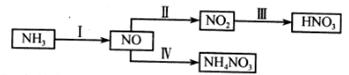
II中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线如下图)。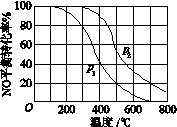
①随温度升高,该反应平衡向__________(选填“正反应”或“逆反应”)方向移动。
②比较P1、P2的大小关系:______________。
(2)一种工业合成氨的简易流程图如下: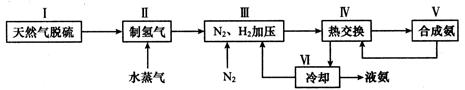
步骤II中制氢气原理如下:
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206.4" kJ/mol
CO(g)+3H2(g) △H =" +206.4" kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H =" —41.2" kJ/mol
CO2(g)+H2(g) △H =" —41.2" kJ/mol
①对于反应a而言,增大CH4的浓度,达新平衡时H2的体积分数_ _ __增大(选填“一定”或“不一定”)。
②利用反应b,将CO进一步转化,可提高H2产量。若在500 ℃时,把等浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005 mol·L-1、c(H2)=0.015 mol·L-1,则CO的平衡转化率为 。
③上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,④简述一种本流程中可以提高合成氨原料总转化率的方法 。
(本小题满分7分)
(1)衣服上沾有动、植物油污,用水洗不掉,但可用汽油洗去,这是因为大多数有机物难而易。有机化工厂附近严禁火种,这是因为绝大多数有机物。
(2)为了检验和除去下表中的各种物质中的杂质(括号里的物质),请从(I)中选出适当的检验试剂,从(II)中选出适当的除杂试剂,将所选的答案填入相应的空格内。
| 物质 |
检验试剂 |
除杂试剂 |
| 甲烷(乙烯) |
||
| 酒精(水) |
(I)检验的试剂:A.无水硫酸铜B.酸性高锰酸钾溶液C.盐酸D.氢氧化钠溶液
(II)除杂试剂:a. 无水硫酸铜 b.氢氧化钠溶液 c.新制的生石灰d.溴水
(本小题满分16分)
Ⅰ.汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出一氧化碳与一氧化氮反应的化学方程式
(2)“催化转换器”的缺点是在一定程度上提高空气的酸度,其原因是
(3)控制城市空气污染源的方法可以有(多选扣分)
a.开发氢能源 b.使用电动车 c.植树造林 d.戴上呼吸面具
Ⅱ.A、B、C、D、E五种短周期元素,原子序数E>D>A>B>C,且A、B、D、E同周期,A、C同主族,A的原子结构示意图如图, B的最外层电子数比K层电子多1,
B的最外层电子数比K层电子多1,
D元素的主族序数是周期序数的2倍,E的单质是黄绿色气体;据此填空:
(1) 指出元素A在周期表中的位置,其气态氢化物的化学式为。
(2) D和E两种元素相比较,非金属性较强的是(填元素符号),
可以验证该结论的是(填写字母序号);
A.比较这两种元素的常见单质的熔沸点 B.比较这两种元素的气态氢化物的熔沸点
C.比较这两种元素的气态氢化物的稳定性 D.比较这两种元素置换能力的强弱
(3)C、D、E三种元素最高价氧化物的水化物的酸性由强到弱的顺序:。(填写化学式)
有下列晶体:①冰②金刚石③氩④过氧化钠⑤二氧化硅⑥氯化镁⑦纯醋酸⑧白磷⑨氯化铵⑩金属铝。用序号回答下列问题:
(1)在一定条件下能导电而不发生化学变化的是;
(2)只含有极性共价键的分子晶体是 ;
(3)固态时,晶体中只含有范德华力的是;
(4)含共价键的离子晶体是 ;
(5)只含有离子键的离子晶体是_______;
(6)只含有非极性键的原子晶体是_________;
I、一定温度下,在容积为V L的密闭容器中进行反应:aN(g) bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中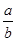 =__________
=__________
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:____________
(3)平衡时,N的转化率为。
(4)下列叙述中能说明上述反应达到平衡状态的是
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
II、(1)氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ·g-1。则燃烧1molH2放出的热量为kJ。
(2)1molN2(g)和1molO2(g)在一定条件下反应生成2molNO(g),吸收180kJ的热量,已知断裂1molN2(g)中的N≡N和1molO2(g)中的O=O分别需要吸收946kJ和498kJ的能量,则1molNO分子中的化学键形成时可释放_______kJ的能量。
已知A、B、C、D为气体,E、F为固体,G为CaCl2,它们之间的转化关系如下: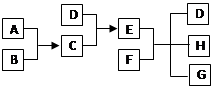
(1)D的结构式为, E的电子式为。
(2)用电子式表示A和B反应形成C的过程。
(3)E和F反应生成D、H和G的化学方程式,该反应的用途是。