结晶玫瑰是具有玫瑰香气的香料,可由下列方法合成(部分反应物及反应条件未标出)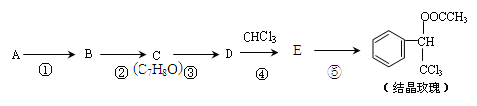
已知:  (-R表示烃基)
(-R表示烃基)
(1)A是苯的一种同系物,相同条件下,其蒸气对氢气的相对密度是46,则A的名称是 。
(2)反应②所需药品及反应条件是 。
(3)C的核磁共振氢谱峰面积之比是 。
(4)⑤的化学方程式是 。
(5)C有多种同分异构体,其中属于芳香族化合物的有 种。
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如 :
:
Na2O+Cl2=2NaCl+O2
CaO+Cl2=CaCl2+O2
SiO2+2CCl4=SiCl4+2COCl2
Cr2O3+3CCl4=2CrCl3+3COCl2
请回答下列问题:
(1)Cr2O3、CrCl3中Cr均为+3价,写出Cr3+的基态电子排布式;
(2)CCl4分子中C原子采取杂化成键。
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是,其中碳氧原子之间共价键是 (填序号):
(填序号):
a.2个σ键b.2个π键c.1个σ键、1个π键
(4)CaO晶胞如右上图所示,CaO晶体中Ca2+的配位数为。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ•mol-1、NaCl-786kJ•mol-1。导致两者晶格能差异的主要原因是。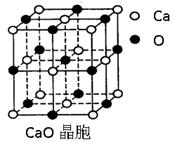
在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下 表:
表:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
1.7 |
1.1 |
1.0 |
0.6 |
0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=。该反应为反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是。
(a)容器中压强不变(b)混合气体中c(CO)不变
(c) 逆(H2)=
逆(H2)=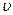 正(H2O)(d)c(CO2)=c(CO)
正(H2O)(d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为。
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl—和SO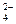 等杂质,提纯工艺路线如下:已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示。
等杂质,提纯工艺路线如下:已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示。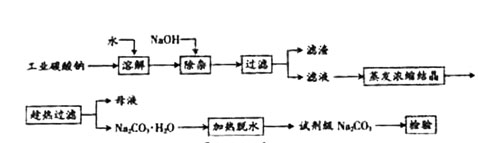
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若“母液”循环使用,可能出现的问题及其原因是 。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)  ΔH1="+532.36" kJ·mol-1
ΔH1="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
不同的金属在化学反应中表现出来的活泼程度不同,俄国化学家贝开托夫在大量实验和系统研究之后,于1865年发表了金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au 。
(1)金属活动性顺序是学习“金属及其化合物”的重要工具,许多“金属及其化合物”的知识规律可以通过金属活动性顺序来掌握。例如,工业上冶炼金属,根据金属 活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、。
活动性顺序可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属是__________、。
工业上又常用下列反应进行金属钾的冶炼: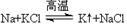 ,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
,似乎“违背”了金属活动性顺序,试解释钠能将更活泼的钾置换出来的原因__________________________ 。
(2)在实践中发现还有许多化学事实 “违背”金属活动性顺序,但这些“反常”现象都可以通过化学原理得到合理解释。某学生在做探究实验时,把锌粒投入1mol·L-1氯化铁溶液中,观察到如下实验现象:锌粒表面有一定 量气泡产生,溶液颜色逐渐变浅,一段时间后溶液
量气泡产生,溶液颜色逐渐变浅,一段时间后溶液 逐渐浑浊,试用相关反应方程式进行解释_________________________________、
逐渐浑浊,试用相关反应方程式进行解释_________________________________、
__________________________________________________________________________。
(3)研究金属活动性顺序还可以指导对金属阳离子氧化性强弱的认识,工业上用氯化铁溶液腐蚀铜制电路板。
①请根据金属活动性顺序结合该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性强弱。
②请运用原电 池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
池原理设计实验验证Cu2+、Fe3+氧化性强弱的结论。
方案___________________________ ___________________________________________。
___________________________________________。
在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
(1)步骤③加Fe粉的目的是。
(2)写出步骤④中反应的离子方程式。
(3)上述生产流程中, 可以循环利用的副产物是。
可以循环利用的副产物是。
(4)操作⑤的名称是,选用的试剂是。