在aLAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的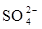 离子完全沉淀;若加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子物质的量浓度(mol/L)为
离子完全沉淀;若加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子物质的量浓度(mol/L)为
A.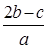 |
B.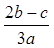 |
C.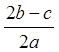 |
D.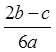 |
银制器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的的银器浸入该溶液中,一段时间后发现黑色会褪去。下列说法正确的是
| A.处理过程中银器一直保持恒重 |
| B.银器为正极,Ag2S被还原生成单质银 |
| C.该过程中总反应为2Al + 3Ag2S =" 6Ag" + Al2S3 |
| D.黑色褪去的原因是黑色Ag2S转化为白色AgCl |
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
| A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 |
| B.脱氧过程中铁作原电池正极,电极反应为:Fe-3e→Fe3+ |
| C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e→4OH- |
| D.含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+ H2O(l) ="=" Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—="=" Mn2O3(s)+2OH—(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g |
结合下图判断,下列叙述正确的是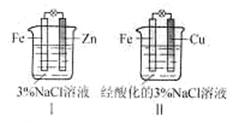
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀 |
根据下图,下列判断中正确的是
| A.烧杯a中的溶液pH降低 |
| B.烧杯b中发生氧化反应 |
| C.烧杯a中发生的反应为2H++2e-===H2 |
| D.烧杯b中发生的反应为2Cl--2e-===Cl2 |