蛋白质在人体肠胃内与水反应,最终生成氨基酸被人体吸收.丙氨酸(化学式C3H7O2N)就是其中的一种.试计算:
(1)丙氨酸的相对分子质量;
(2)丙氨酸中各元素的质量比;
(3)丙氨酸中氮元素的质量分数.(计算结果精确到0.1%).
如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表。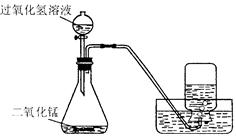
| 气体发生装置内物质的总质量 |
|
| 反应前 |
35.6 |
| 反应后 |
34.8 |
(l)反应中二氧化锰的作用是。
(2)反应生成氧气的质量为g(结果精确到0. 1 g,下同)。
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程。
实验室里可用锌与稀硫酸反应制取氢气:
Zn + H2SO4 = ZnSO4 + H2↑
某实验需要氢气2.24L。
(1)求参加反应的锌的质量。
(2)某兴趣小组用的是从废旧电池中得到的含杂质10%的锌皮制取氢气。现有这种废锌皮15g,与足量稀硫酸反应,最多得到氢气多少g?
实验室用分解高锰酸钾制氧气。若31.6g高锰酸钾完全分解可制得多少氧气?同时得到多少克二氧化锰?
鸡蛋壳的主要成分是碳酸钙,某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半,试计算(计算结果保留1位小数)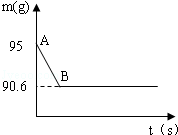
(1)产生CO2的质量为g;
(2)该鸡蛋壳中CaCO3的质量分数;
(3)所用稀盐酸中溶质的质量分数;
向8g CuO粉末中加入100g稀H2SO4,恰好完全反应,求: