(共20分)工业上常用分离液态空气法制取氧气,实验室常用物质分解的方法制氧气。某校化学兴趣小组的同学根据实验室提供的仪器和药品,在老师的指导下从下图中选择装置进行了氧气的制备实验。
(1)工业制氧气是 (填“物理”或“化学”)变化,仪器a的名称是: 。
(2)甲同学从上图中选择B、E装置的组合制取氧气,反应的符号表达为: 。反应类型为( )收集氧气还可选用的装置是 。
(3)若用装置B制氧气,反应通常很剧烈,据此提出实验安全注意事项是
A.更换部分仪器,控制液体的加入速度
B.用体积小的广口瓶
C.加热反应物
D.减小过氧化氢浓度
(4)氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,应选用上图 作发生装置,收集氨气最好用上图 装置。
(5)乙同学称取一定质量的KMnO4固体放入大试管中,将温度控制在250℃加热制取O2.实验结束时,乙同学发现收集到的O2大于理论产量.针对这一现象,同学们进行了如下探究:
【提出猜想】猜想Ⅰ:反应生成的MnO2分解放出O2;
猜想Ⅱ:反应生成的K2MnO4分解放出O2;
猜想Ⅲ:反应生成的K2MnO4和MnO2分解放出O2.
【实验验证】同学们分成两组,分别进行下列实验:第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变,则猜测 错误;第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法得出了猜想Ⅱ正确的结论.该组同学选择的实验方法是 。
(6)丙同学阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣,请你一起参与实验探究,并填写下列空白:。
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】丙同学以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略)。
(Ⅰ)上述实验应测量的“待测数据”是 。
(Ⅱ)若实验②比实验①的“待测数据”更 (填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率。
(Ⅲ)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若测量得到0.5g氧化铜( CuO )粉末,再将黑色粉末放入试管中, 。(简述操作和现象)
【预期结论】氧化铜还能作氯酸钾分解的催化剂。
【评价设计】你认为丙同学设计实验③和实验②对比的目的是 。
用如图所示装置分别进行两个实验(已知:氯化钙溶液呈中性).
(1)打开止水夹,向Ⅰ中液体加入一种黑色固体、Ⅱ中液体加入一种白色固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体内出现燃烧现象.
①写出燃烧反应的化学方程式 .
②请说明Ⅱ中出现燃烧的原因 .
(2)打开止水夹,向Ⅰ中液体加入一小块固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体出现浑浊现象.关闭止水夹,发现Ⅱ中液面上升,溶液由浑浊变澄清.
①请说明溶液由浑浊变澄清的原因 .
②若实验后Ⅱ中澄清液中的溶质由一种或两种物质组成,为检验其成分,应该进行的实验操作是
.
化学小组同学在课外读物中看到:“Na2O2广泛应用于潜艇的呼吸供氧和CO2的去除.”他们决定探究CO2与Na2O2反应的产物.提出猜想CO2与Na2O2反应可能生成O2和Na2CO3.查阅资料
①Na2O2是一种淡黄色固体,常温下与CO2、H2O等物质反应,反应的化学方程式分别为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
②CO2既不与NaHCO3反应,也不溶于饱和的NaHCO3溶液中.
③Na2O2与稀盐酸反应时,生成NaCl、H2O和O2.
实验过程同学们在老师的指导下利用如下图所示装置(部分夹持仪器已略去)进行实验
(1)实验时上述仪器正确的连接顺序为m接 (填接口字母).
(2)检验有氧气产生的方法是将 放在接口 处(填接口字母);证明有氧气产生的实验现象是 .
(3)检验有Na2CO3生成的方法是 .
(4)使气体通过D装置的原因是 .
老师在讲解溶洞的形成时,告诉了同学们一个新的化学反应:
CaCO3+CO2+H2O=Ca(HCO3)2
化学兴趣小组的同学们提出一个大胆的猜想:“Na2CO3溶液也能与CO2发生反应”.
为了确定同学们的猜想是否正确,兴趣小组在老师的指导下,通过实验探究的方法,完成了对该猜想的判断.请你完成兴趣小组在实验探究活动中的部分实验报告.
【实验目的】:探究Na2CO3溶液能否与CO2反应
【实验药品】:大理石、CaO、Na2CO3溶液、饱和的NaHCO3溶液、CaCl2溶液、浓盐酸、稀硫酸、浓硫酸、澄清石灰水
【查阅资料】:
①2NaHCO3+Ca(OH)2=CaCO3↓+Na2CO3+2H2O;
②Na2CO3+CaCl2═CaCO3↓+2NaCl
③2NaHCO3+CaCl2═CaCO3↓+2NaCl+H2O+CO2↑
④二氧化碳能溶于水,但几乎不溶于饱和NaHCO3溶液
【实验装置】:如图
【实验操作步骤与现象】:
①制取二氧化碳时应选用上述的 (请从以上给出的药品中选择并填药品的名称)
②装置Ⅱ中盛放的饱和NaHCO3溶液的作用是 .
③使过量的CO2通过装置Ш,充分反应后,将其中所得的溶液取出3mL于试管中,然后向试管中加入 试剂(请从以上给出的药品中选择并填药品的名称)
a.当试管中 现象时,Na2CO3溶液与CO2没有发生反应;
b.当试管中 现象时,Na2CO3溶液与CO2发生了化学反应,其反应的化学方程式为 .
【结论】:通过实验探究,同学们的猜想是正确的.
葡萄糖是生命体所需能量的主要来源.
提出问题:葡萄糖燃烧的产物是CO2和H2O,由此能否推断葡萄糖是由碳元素和氢元素组成的有机物?
实验设计:为了确定葡萄糖的元素组成,某小组设计了如下实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略,假设每个装置中均吸收完全或反应完全。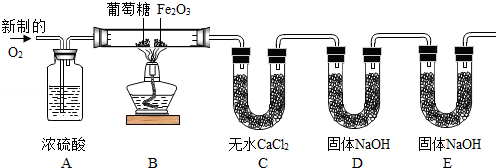
| 小贴士 含碳元素的化合物完全燃烧生成CO2 、H2O,不完全燃烧时生成CO、CO2 和H2O |
(1)装置A中浓硫酸的作用是
(2)装置B处Fe2O3可能发生的化学反应的方程式为 .
方案评价:
用充有空气的储气球代替制备氧气的装置,是否更有利于实验的进行,为什么? .(填“是”或“否”及理由)
数据处理:下表是同学们填写的实验报告,请你帮助完成.
| 实验事实 |
数据分析及结论 |
| 1.8g葡萄糖完全燃烧,得到2.64g CO2和1.08g H2O |
结论:葡萄糖含有 元素 数据分析的依据是 . |
讨论交流:上述实验装置D、E中盛放的都是NaOH固体,试分析两次使用NaOH固体的作用分别是什么? .
CaO和NaOH固体的混合物,俗名“碱石灰”,实验室常用作干燥剂.碱石灰在空气久置会吸收空气中的水和二氧化碳而变质.某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程. 请你参与探究过程: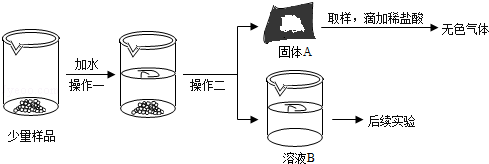
(1)为了使样品充分溶解,操作一定还要用到的玻璃仪器是 ;操作二的名称是 .
(2)固体A中一定含有 .
(3)溶液B成分的探究.
[查阅资料]
①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性.
[猜想]
溶液B中溶质可能为:①NaOH; ②Na2CO3; ③NaOH和Na2CO3;④Ca(OH)2和
[设计方案并进行实验]
甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3.
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH.
[反思与评价]
丙同学认真分析上述二位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断.他认为B溶液中一定含有Na2CO3,可能含有NaOH.为进一步确认溶液B中是否含NaOH,做做了如下实验.
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液; ②过滤,在滤液中滴加酚酞试液 |
①有白色沉淀生成 ②溶液由无色变为红色 |
猜想③正确 |
实验步骤①中发生的化学反应方程式是 ,其实验目的是 .
(4)实验过程中,同学们发现向样品中加水时还放出大量的热.综合以上探究,下列对样品成分分析正确的是 (填序号).
A.一定有NaOH B.一定有Na2CO3 C.一定有CaO D.至少有NaOH、CaO中的一种.