下列热化学方程式中ΔH的数值表示可燃物燃烧热的是
| A.N2H4(g)+O2(g)===N2 (g)+ 2H2O(g)ΔH=-534.4 kJ·mol-1 |
| B.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1 |
| C.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1 |
D.CO(g)+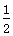 O2(g)===CO2(g)ΔH=-283 kJ·mol-1 O2(g)===CO2(g)ΔH=-283 kJ·mol-1 |
用铁片与稀硫酸反应制氢气时,下列措施不能使反应速率加快的是
| A.加热 |
| B.不用稀硫酸,改用98%的浓硫酸 |
| C.滴加少量CuSO4溶液 |
| D.不用铁片,改用铁粉 |
据报道,月球上有大量3He存在,以下关于3He的说法正确的是
| A.是4He的同素异形体 | B.比4He多一个中子 |
| C.是4He的同位素 | D.比4He少一个质子 |
下列各反应属于加成反应的是
| A.CH4 + 2O2 → CO2 + 2H2O |
| B.CH2=CH2 + Br2 → CH2Br—CH2Br |
| C.CH4 + Cl2 → CH3Cl + HCl |
| D.2CH3CH2OH + O2 → 2CH3CHO + 2H2O |
下列叙述正确的是
| A.电镀时,通常把待镀的金属制品作阳极 |
| B.右图中电子由Zn极流向Cu,盐桥中的Cl–移向CuSO4溶液 |
| C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e–=2H2O |
| D.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
下列溶液中微粒浓度关系一定正确的是
| A.室温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl–)=c(NH4+) |
| B.pH=1的一元酸和pH=13的一元碱等体积混合:c(OH–)=c(H+) |
| C.0.1 mol·L–1的(NH4)2SO4溶液中:c(NH4+)>c(SO42–)>c(H+)>c(OH–) |
| D.0.1 mol·L-1的Na2S溶液中:c(OH–)=c(H+)+c(HS–)+c(H2S) |