在碱性锌锰干电池中,已知氢氧化钾为电解质,发生的电池总反应为:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。下列该电池的电极反应,正确的是
| A.负极反应为Zn-2e-===Zn2+ |
| B.负极反应为Zn+2H2O-2e-===Zn(OH)2+2H+ |
| C.正极反应为2MnO2+2H2O+2e-===2MnOOH+2OH- |
| D.正极反应为2MnO2+2H++2e-===2MnOOH |
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的Fe2(SO4)3、ZnSO4和K2SO4三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
| A.1∶2∶3 | B.3∶2∶2 | C.3∶1∶1 | D.1∶3∶3 |
下列各物质所含原子数目,按由大到小顺序排列的是
①0.5mol NH3 ②标准状况下22.4 L He ③4℃ 9mL 水 ④0.2mol H3PO4
| A.④③②① | B.①④③② |
| C.①④②③ | D.②③④① |
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4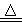 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中错误的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中错误的是
| A.KClO3在反应中得到电子 |
| B.ClO2中氯的化合价为+4价 |
| C.在反应中H2C2O4是还原剂 |
| D.1 mol KClO3参加反应有2mol电子转移 |
向含有NaBr 、KI的混合溶液中通入过量的Cl2充分反应。将溶液蒸干并灼烧,最后剩余的固体物质是
| A.NaCl 和KI | B.NaCl、KCl和I2 |
| C.KCl和NaBr | D.KCl和NaCl |
下列条件下,两瓶气体所含分子数一定相等的是
| A.同体积、同密度的O3和O2 |
| B.同温度、同体积的H2和N2 |
| C.同体积、同密度的N2和CO |
| D.同压强、同体积的N2O和CO2 |