汽车的启动电源常用铅蓄电池,放电时的电池反应如下:Pb+ PbO2 + 2H2SO4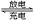 2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
2PbSO4 + 2H2O根据此反应判断下列叙述中正确的是
| A.放电时PbO2是电池的负极 |
| B.放电时,负极的电极反应式为:Pb+SO42--2e-=PbSO4 |
| C.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 |
| D.充电时,该电池的正极接电源的负极 |
黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时的反应是:
S+2KNO3+3C=K2S+N2↑+3CO2↑,该反应的还原剂是
| A.C | B.C和S | C.KNO3 | D.S和KNO3 |
已知在酸性溶液中的还原性强弱顺序为:SO2 >I–>H2O2>Fe2+>Cl–,下列反应不可能发生的是:
| A.H2O2+ H2SO4=SO2↑+ O2↑+2 H2O |
| B.2I– +2Fe3+=I2+2 Fe2+ |
| C.2Fe3++ SO2 +2H2O=2Fe2++SO42– +4H+ |
| D.SO2 +2 H2O+ I2=H2SO4+2HI |
下列叙述中不正确的是
| A.向氯化钙溶液中通入少量CO2,有白色沉淀CaCO3生成 |
| B.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
| C.向NaAlO2溶液中通入过量CO2,有白色胶状沉淀析出 |
| D.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下生成CO2体积比为53∶42 |
把X溶液逐滴滴入Y溶液中,与把Y溶液逐滴滴入X溶液中,反应现象不同的是
| A |
B |
C |
D |
|
| X |
NaHCO3 |
NaAlO2 |
NaHCO3 |
MgCl2 |
| Y |
Ca(OH)2 |
HCl |
HCl |
NaOH |
下列各组中两种物质在溶液里的反应,可用同一离子方程式表示的是
| A.KCl+AgNO3;AlCl3+ AgNO3 |
| B.NaHCO3+H2SO4;Na2CO3+HCl |
| C.NaHCO3+NaOH;Ca(HCO3)+KOH |
| D.BaCl2+H2SO4;Ba(OH)2+H2SO4 |