(1)已知完全断裂1 mol氮气中的键需要吸收热量946kJ,完全断裂1 mol氢气中的键需要吸收热量436KJ,根据热化学方程式: N2(g) + 3H2(g)="=" 2NH3(g) △H=-92.4kJ·mol-1
则氨气中1molN—H键断裂时吸收热量是_______ kJ。
(2)0.2mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态的三氧化二硼和液态水,放出433kJ热量,其热化学方程式为______________________________________
又已知:H2O(l)===H2O(g)ΔH=+44 kJ·mol-1。则5.6 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是__________kJ。
在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
| A.氧化亚铜(Cu2O) | B.氧化钴(Co2O3) |
| C.氧化铅(PbO) | D.硼砂(Na2B4O7·10H2O) |
(1)制造化学仪器的玻璃需加入的物质是______。
(2)制造光学仪器的玻璃需加入的物质是______。
(3)制造蓝色玻璃需加入的物质是____________。
(4)制造红色玻璃需加入的物质是____________。
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。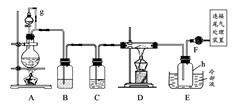
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
| 熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
| 升华温 度/℃ |
- |
- |
180 |
300 |
162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式_________________________。
(2)装置E中的h瓶需要冷却的理由是_______________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂?________(填“是”或“否”),请说明理由__________________________________。
②某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000 × 10-2 mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,则残留物中铁元素的质量分数是_______。
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择)。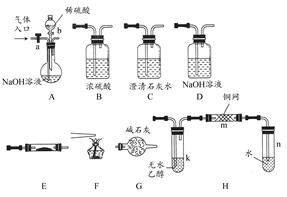
(1)若气体入口通入CO和CO2的混合气体,E内放置CuO,选择装置获得纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为________(填字母),能验证CO氧化产物的现象是________。
(2)停止CO和CO2混合气体的通入,E内放置Na2O2,按A―→E―→D―→B―→H装置顺序制取纯净干燥的O2,并用O2氧化乙醇。此时,活塞a应________,活塞b应________,需要加热的仪器装置有________(填代号),m中反应的化学方程式为________。
金刚石、SiC具有优良的耐磨、耐腐蚀特性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子。碳元素在周期表中的位置是____________,Q是____________,R的电子式为________。
(2)一定条件下,Na还原CCl4可制备金刚石。反应结束冷却至室温后,回收其中的CCl4的实验操作名称为________,除去粗产品中少量钠的试剂为________。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L。生成氢气的离子方程式为__________________________________,硅酸盐的物质的量浓度为_________。
(4)下列叙述正确的有________(填序号)。
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2
2010年5月15日,CCTV对“南澳一号”沉船的考古进行了两个小时的现场直播,从沉船中发现了大量宋代精美瓷器,体现了灿烂的中华文明。
青花瓷胎体的原料——高岭土[Al2Si2O5(OH)x],可掺进瓷石制胎,青花瓷釉料的成分主要是钾长石(KAlSi3O8),在1300℃左右一次烧成的釉可形成精美的青花瓷。
(1)下列说法正确的是________(填序号)。
A.高岭土分子中x=2
B.钾长石能完全溶解在盐酸中形成澄清的溶液
C.烧制青花瓷过程中发生了复杂的物理变化和化学变化
D.青花瓷、玻璃、水泥都属于硅酸盐产品
(2)在“南澳一号”考古直播过程中,需用高纯度SiO2制造的光纤。如图是用海边的石英砂(含氯化钠、氧化铝等杂质)制备二氧化硅粗产品的工艺流程: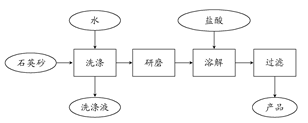
①洗涤石英砂的目的是___________________________________。
②二氧化硅与氢氧化钠溶液反应的离子方程式是______________________
③在以上流程中,要将洗净的石英砂研磨成粉末,目的是_____________。
④工业上常用纯净石英砂与C在高温下发生反应制造粗硅,粗硅中含有SiC,其中Si和SiC的物质的量之比为1:1。下列说法正确的是________(填序号)。
A.SiC性质稳定,能用于制造抗高温水泥
B.制造粗硅时的反应为:2SiO2+5C Si+SiC+4CO↑
Si+SiC+4CO↑
C.在以上流程中,将盐酸改为NaOH溶液,也可达到目的
D.纯净的SiO2只能用于制造光导纤维