下列电离方程式正确的是
A.H2SO4===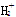 + + |
| B.Ba(OH)2===Ba2++2OH- |
| C.NaNO3=== Na+ + N5+ + O32- |
D.K2CO3=== K++ |
有BaCl2和NaCl的混合溶液w L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗a mol H2SO4、b mol AgNO3。据此得知原混合溶液中的c(Na+) mol/L为
| A.(2b-4a)/w | B.(b-a)/w |
| C.(2b-2a)/w | D.(b-2a)/w |
在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
①BrCl的化学性质和Cl2相似,Cl2与水反应是氧化还原反应,BrCl+H2O=HCl+HBrO也是氧化还原反应
②弱碱性条件下,甲酸乙酯能与氢氧化铜反应,乙酸乙酯也能与氢氧化铜反应
③苯不能使酸性高锰酸钾褪色,甲苯也不能使酸性高锰酸钾褪色
④Al(OH)3、Cu(OH)2受热易分解,Fe(OH)3受热也易分解
⑤37℃时,Fe3+、Cu2+能催化H2O2的分解;80℃时,MnO2、过氧化氢酶也能催化H2O2的分解
| A.①②④⑤ | B.④⑤ | C.②③ | D.④ |
对 的表述不正确的是
的表述不正确的是
| A.该物质能发生缩聚反应 |
| B.该物质的核磁共振氢谱上共有7个峰 |
| C.该物质遇FeCl3溶液显色,1mol该物质最多能与含1mol Br2的溴水发生取代反应 |
| D.1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |
下图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是
| A.a的溶解度大于b的溶解度 |
| B.在t℃时,a、b的饱和溶液中溶质的物质的量浓度相同 |
| C.当a中含有少量b时,可以用冷却结晶法提纯a |
| D.在t℃时,将a、b的饱和溶液升温后,溶质的质量分数:a﹥b |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式(未配平)为: SnCl2+Cl-+H3AsO3+H+ As+SnCl62-+M,关于该反应的说法中正确的是
As+SnCl62-+M,关于该反应的说法中正确的是
| A.氧化剂是H3AsO3 |
| B.还原性:Cl->As |
| C.每生成2molAs,反应中转移电子的物质的量为3mol |
| D.M为OH- |