NA为阿伏伽德罗常数,下列叙述错误的是
| A.标准状况下,11. 2 L氦气中含有0.5 NA原子 |
| B.常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA |
| C.标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0. 2 NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中两极产生气体的总物质的量为
| A.0.1 mol | B.0.2 mol | C.0.3 mol | D.0.4 mol |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是 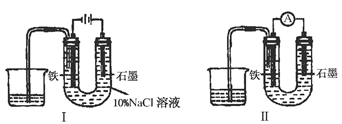
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-===Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-===H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |
下列与氯有关的说法中,正确的是
| A.通过化学变化可以实现35Cl与37Cl间的相互转化 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.电解NaCl溶液得到22.4LH2 (标准状况),理论上需要转移1mol电子 |
下列叙述正确的是()
| A.在pH=1的溶液中,Cu2+、Fe2+、NO3-和SO42-能大量共存 |
| B.用惰性电极电解饱和氯化钠溶液的离子方程式:2Cl- + 2H+ = H2↑+ Cl2↑ |
| C.镁铝合金被碱液腐蚀时,负极反应式为:Mg — 2e- = Mg2+ |
| D.检验某未知溶液中是否含SO42-时,应先加盐酸酸化,再加BaCl2溶液 |
关于下列图示的说法中,正确的是
| A.图①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
| B.用图②所示实验装置排空气法收集CO2气体 |
C.图③表示可逆反应CO(g)+H2O(g) CO2(g)+H2(g)的ΔH大于0 CO2(g)+H2(g)的ΔH大于0 |
| D.图④装置可以用来除去SO2中的HCl |