工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下:
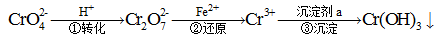
其中第①步中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。下列有关说法正确的是
Cr2O72-(橙色)+H2O。下列有关说法正确的是
| A.第①步当2c (Cr2O72-)=c(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.Cr(OH)3是一种两性氢氧化物,所以像Al(OH)3一样能溶于氨水和碳酸溶液中 |
| D.第②步中,还原0.1 mol Cr2O72-需要91.2 g FeSO4 |
一定能在下列溶液中大量共存的离子组是()
| A.pH=0的溶液:Fe2+、Mg2+、NO3-、SO42- |
| B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl- |
| C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl- |
| D.pH=14的溶液:Na+、K+、AlO2-、CO32- |
下列反应中氯元素被氧化的是()
A.MnO2+4HCl MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| B.2HCl+Ca(OH)2=CaCl2+2H2O |
| C.5Cl2+I2+6H2O=10HCl+2HIO3 |
D.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
用NA表示阿伏加德罗常数的值。下列叙述正确的是()
| A.25℃时,pH=1的1.0 LH2SO4溶液中含有的H+的数目为0.2NA |
| B.标准状况下,2.24 LCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| C.室温下,21.0 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
| D.取0.5 L 0.2 mol·L-1mol氯化铁溶液 ,所得溶液含有0.1 NA个Fe3+ |
已知Na2SO3易被空气氧化变质,欲用氧化还原滴定法来测定实验室里Na2SO3的纯度。取实验室里Na2SO3样品63g,溶于水配成250mL溶液。从其中取出25mL Na2SO3溶液用0.4mol·L-1酸性KMnO4溶液滴定,当溶液刚好变为紫色且半分钟不褪色时,用去40mL酸性KMnO4溶液(已知:5SO32-+2MnO4-+6H+5SO42-+2Mn2++3H2O)。则实验室里的Na2SO3的纯度为多少?
将15.2gFe、Cu组成的合金溶于过量的稀硝酸中,生成4.48LNO(标准状况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为
| A.33.2g | B.25.4g | C.22.4g | D.19.6g |