ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4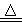 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中错误的是
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法中错误的是
| A.KClO3在反应中得到电子 |
| B.ClO2中氯的化合价为+4价 |
| C.在反应中H2C2O4是还原剂 |
| D.1 mol KClO3参加反应有2mol电子转移 |
同物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的体积比是3 :2 :1,则三溶液中氯离子的物质的量浓度之比为
| A.3 :4 :3 | B.1 :2 :3 |
| C.1 :1 :1 | D.6 :3 :2 |
设NA为阿伏伽德罗常数的值,下列有关说法不正确的是
| A.45g水中含有的水分子数是2.5NA |
| B.标准状况下,33.6LCO中含有的原子数是3NA |
| C.0.5L0.2mol/L的NaCl (aq)中含有的Na+数是0.1NA |
| D.1molH2O中含电子数目为9NA |
已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是
| A.16 g | B.32 g | C.64 g/mol | D.32 g /mol |
在标准状况下,如果2.8L氧气含有n个氧原子,则阿伏加德罗常数可表示为
| A.n/8mol-1 | B.n/16 mol-1 | C.8n mol-1 | D.4n mol-1 |
下列有关说法正确的是
| A.能在水溶液或熔融状态下导电的物质是电解质 |
| B.电离出氢离子的化合物是酸 |
| C.纳米材料也是一种胶体 |
| D.丁达尔效应,是胶体粒子对光散射形成的 |