设NA为阿伏加德罗常数,下列说法正确的是( )
| A.标准状况下,0.1 molCl2溶于水,转移的电子数目为0.1NA |
| B.物质的量浓度为0.1mol·L-1的MgCl2溶液中,含有Cl-个数为0.2NA |
| C.标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA |
| D.常温下,22gCO2和N2O混合气体中,含有的原子数目为1.5NA |
利用下图装置可以模拟铁的电化学防护。下列说法不正确的是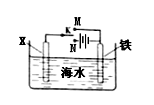
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于M处,铁极发生氧化反应 |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀 |
| D.若X为碳棒,开关K置于N处,X极发生氧化反应 |
下列实验过程中,始终无明显现象的是
| A.NO2通入FeSO4溶液中 | B.SO2通入已酸化的Ba(NO3)2溶液中 |
| C.CO2通入Na2SiO3溶液中 | D.SO2通入CaCl2溶液中 |
下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集Cl2:Cl2 + H2O  H+ + Cl-+ HClO H+ + Cl-+ HClO |
B.用热的纯碱溶液清洗油污:CO32- + 2H2O  H2CO3 + 2OH- H2CO3 + 2OH- |
| C.用Na2CO3溶液处理水垢中的CaSO4:CaSO4 + CO32-= CaCO3 + SO42- |
D.用TiCl4制备TiO2:TiCl4 +(x+2)H2O(过量) TiO2·x H2O↓+ 4HCl TiO2·x H2O↓+ 4HCl |
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入盐酸酸化的BaCl2溶液,有白色沉淀产生。下列推断正确的是
| A.肯定有A13+、Mg2+、Cl- | B.肯定有A13+、Mg2+、NH4+ |
| C.肯定有K+、HCO3-、MnO4- | D.肯定有A13+、Mg2+、SO42- |
下图所示的实验方法、装置或操作完全正确的是