已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)参加反应的NH3和作为还原剂的NH3的个数比为多少?
(2)若标准状况下33.6LCl2参加反应则被氧化的NH3的质量为多少?将还原产物溶于水配成500ml溶液其物质的量浓度为多少? (有计算步骤)
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示,试根据元素在周期表中的位置,分析图中曲线的变化特点.并回答下列问题。
1至19号元素气态原子失去最外层一个电子所需能量:

⑴同主族内不同元素的E值变化的特点是:________________。各主族中E值的这种变化特点体现了元素性质的________________________变化规律。
⑵同周期内,随原子序数增大,E值增大,但个别元素的E值出现反常现象,试预测下列关系式中正确的是_________________________(填写编号,多选倒扣)
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
⑶估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:________<E<________。
⑷10号元素E值较大的原因是_______________________________。
铁元素核外有26个电子
⑴铁元素位于元素周期表中第___________周期,第___________族。
⑵Fe3+的电子排布式___________。
⑶Fe2+的外围电子轨道表示式___________。
⑷为什么Fe3+在自然界Fe的各种存在形式中最为常见?___________。
⑸目前发现的铁的最高化合价是+6价,理论上最高价是___________。
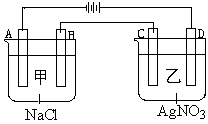
甲、乙两个容器中,分别加入0.1mol/LNaCl溶液与0.1mol/LAgNO3溶液后,以Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为:_____________
硼酸是硼的氢氧化物,已知其结构为平面三角形结构。
(1)画出硼酸的结构图式。
(2)硼酸为无色晶体,可溶于水,水溶液显弱酸性。已知硼酸本身不能电离出H+,它的电离必须有H2O参加,电离后形成正四面体形的硼酸根离子,试写出硼酸电离的方程式(以结构式表示)。
现有A、B、C三种物质,A为气态氢化物,分子式为RH3,含R为82.4%,B是另一种气态氢化物,A+B→C,C与碱液共热放出A。C的水溶液加入稀HNO3酸化后,滴入AgNO3溶液,产生不溶性的白色沉淀,完成下列问题:
(1)写出A的名称和电子式,并指出它是否是极性分子?其稳定性比PH3、H2O强还是弱?
(2)写出B的名称和电子式,并指出它是否是极性分子?其稳定性比HF、H2S、HBr如何?其水溶液的酸性比HF、HBr、H2S如何?
(3)写出C的名称和电子式,具体指明C物质中各部分的化学键,指出C形成的晶体类型。
(4)写出上述有关的化学方程式或离子方程式。