下列关于化学反应的描述中正确的是
| A.需要加热才能发生的反应一定是吸热反应 |
| B.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量 |
| C.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g) △H=-283.0kJ/mol |
| D.已知2C(s)+2O2(g)=2CO2(g) △H=akJ/mol,2C(s)+O2(g)="2CO(g)" △H=bkJ/mol,则b>a |
下列不能用勒沙特列原理解释的是
| A.用排饱和食盐水法收集Cl2 | B.棕红色NO2加压后颜色先变深后变浅; |
| C.打开汽水瓶时,有大量气泡溢出; | D.H2、I2、HI平衡混和气加压后颜色变深 |
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起
| A.溶液的pH增大 | B.CH3COOH的电离程度增大 |
| C.溶液的导电能力减小 | D.溶液的c ( OH –)减小 |
分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是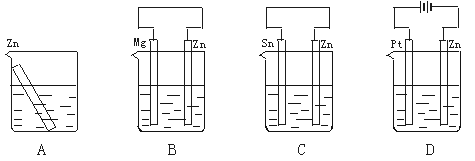
用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度
| A.偏高 | B.偏低 | C.不受影响 | D.不能确定 |
已知450℃时,反应H2(g)+I2(g)  2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)  H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
| A.50 | B.0.02 | C.100 | D.无法确定 |