次磷酸(H3PO2)可发生下列反应而用于化学镀银。
Ag++ H3PO2+ H2O — Ag + H3PO4+ H+
试回答下列问题:
H3PO2中,P元素的化合价为________;该反应中,H3PO2做 (氧化剂、还原剂)
H3PO2是一种中强酸,写出其电离方程式: 。
配平离子方程式。
用双线桥法标出电子转移的数目。
若反应中生成5.4 g Ag,则转移电子个数为 。
已知重水(D2O)和乙酸之间会发生氢交换:
D2O+CH3COOH CH3COOD+HDO
CH3COOD+HDO
次磷酸(H3PO2)与D2O之间也能发生氢交换,但次磷酸钠(NaH2PO2)与D2O之间不能发生氢交换,从分类来看,NaH2PO2属于
| A.正盐 | B.酸式盐 | C.钠盐 | D.氧化物 |
已知反应①、②是化工生产中的两个重要反应:
①
②乙为硫铁矿(主要成分FeS2)经过粉碎后在沸腾炉中燃烧得到D和E(该反应为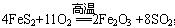 ;△H<0)。其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
;△H<0)。其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体。请回答:
(1)A的电子式是。
(2)将A通入B的溶液中,反应的离子方程式是。
(3)1 g C在A中燃烧时放出92.3 kJ的热量,该反应的热化学方程式是。
(4)工业上可利用E为原料冶炼其中所含的金属,方法是。
(5)将A和D按物质的量1:1通入下列装置中:
该过程中的化学方程式是。
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出。
(6)一定条件下,将12 g乙放入过量的的浓硝酸中,反应过程中转移1.5 mol电子,该反应的离子方程式是。
有A、B、C、D、E五种短周期主族元素,原子序数按A、B、C、D、E顺序增大,A是半径最小的原子,B最外层电子数是次外层电子数的2倍,C2-与E+最外层电子数均为次外层的4倍,E和B 同主族。
(1)A、C、D三种元素形成的化合物的电子式_____________.
(2)BC2的电子式_____________.属_____________分子(填分子极性)。
EC2其固体属____________晶体。
(3)用电子式表示D2 C的形成过程_____________.
(4)B、C、D、E单质熔点由高到低的顺序为____________(填单质化学式)
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 |
Ag+ Na+ |
| 阴离子 |
NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中C电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的_______极(填写“正”或“负”),甲、乙电解质分别为_______、_______(填写化学式)。
(2)计算电极f上生成的气体在标准状况下的体积_____________。
(3)写出乙烧杯的电解池总反应_____________________________。
(4)若电解后甲溶液的体积为25L,则该溶液的pH为___________ 。
(5)要使丙恢复到原来的状态,应加入g 。(填写化学式)
某离子晶体晶胞结构如下图所示,X位于立方体的顶点,Y位于立方体中心。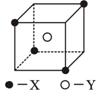
试分析:
(1)晶体中每个Y同时吸引着__________个X,每个X同时吸引着__________个Y,该晶体的化学式为。
(2)晶体中在每个X周围与它最接近且距离相等的X共有_________________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
(4)设该晶体的摩尔质量为M g·mol-1,晶体密度为ρg·cm-3,阿伏加德罗常数为NA mol-1,计算此晶体中两个距离最近的X中心间的距离______________________cm。
短周期元素X、Y、Z、M、N原子序数依次增大,有关信息如下:
| 元素 |
有关信息 |
| X |
最外层电子数是次外层的2倍 |
| Y |
元素主要化合价为–2价 |
| Z |
其单质及化合物的焰色为黄色 |
| M |
与X同主族,其单质为半导体材料 |
| N |
 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 其单质在Y单质中燃烧,发出明亮的蓝紫色火焰 |
(1)XY2的电子式是;Z2Y2中所含化学键类型是;XY2与Z2Y2反应的化学方程式是。
(2)恒容条件下,一定量的NY2、Y2发生反应:2NY2(g)+Y2(g) 2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图,该反应的△H0(填“>”“<”或“=”);若T1、T2时反应的化学平衡常数分别为K1、K2,则K1K2(填“>”“<”或“=”)。
2NY3(g)。温度分别为T1和T2时,NY3的体积分数随时间变化如下图,该反应的△H0(填“>”“<”或“=”);若T1、T2时反应的化学平衡常数分别为K1、K2,则K1K2(填“>”“<”或“=”)。
(3)X的非金属性比M(填“强”或“弱”),能证明此结论的事实是(用离子方程式表示)。