活性氧化锌在橡胶、化工、涂料、陶瓷、医药、电子等行业有着广泛的应用。但随着锌资源的不断开发和利用,锌矿资源越来越少,因此研究利用锌二次资源对缓解锌资源枯竭进程具有重要意义。下图是以含锌铜烟尘(火法炼铜的副产品,主要成分是ZnO、CuO和FeO)制备活性氧化锌的工艺流程: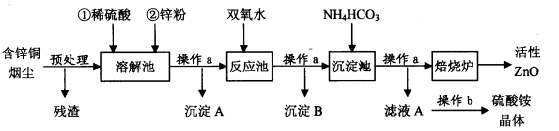
含锌铜烟尘经过预处理后的主要成分为ZnO,还含有少量的CuO和Fe2O3。
(1)操作a名称是____ ,在实验室中,该过程用到的主要玻璃仪器有 。
(2)溶解池中待固体全部溶解后,加入锌粉的作用有:
①将Fe3+还原为Fe2+;② :③调节溶液的pH(控制其在5,0-5.4之间)。
(3)检验溶解池中Fe3+已全部被还原为Fe2+的最佳试剂是 ;
(4)右表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为
1.0 mol-l计算)。反应池中的温度控制在90-95℃,请写出反应池中所发生反应的离子方
程式: 。
| |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Fe2+ |
5.8 |
8.8 |
| 2n2+ |
5.9 |
8.9 |
(5)操作b的名称是________ ;
(6)沉淀池中得到的沉淀化学式可以表示为:aZnCO3·bZn(OH)2·cH2O(a、b、c均为整数)。某校化学兴趣小组的同学为了确定其组成,进行如下实验:称取3.59g沉淀进行焙烧,将焙烧过程中产生的气体依次通过足量的浓硫酸和碱石灰,它们分别增重0.72g和0.44g,则该沉淀的组成为 。

(1)各步所加的试剂为:A__________,B__________,C__________。
(2)_________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是_________
_______________________________________________________________________________。
(3)当析出2.16g单质沉淀时,淀粉的水解率为_________。
(4)上述实验中有一处明显的错误,应如何改正________________________________。
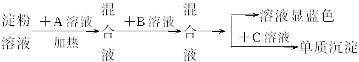
(1)各步所加的试剂为:A_____________,B_____________,C_____________。
(2)_____________(填“可以”或“不可以”)只加A溶液而不加B溶液,原因是____________________________________________________。
(3)当析出2.16 g单质沉淀时,淀粉的水解率为_____________。
用一氧化碳和氢气在443—473 K温度下,并用钴作催化剂时,可以反应生成
n=5—8的烷烃,这是人工合成汽油的方法之一。
(1)写出用CnH2n+2表示的人工合成汽油的配平的化学方程式_____________________。
(2)如果向密闭的合成塔里通入恰好能完全反应的CO和H2,当完全反应后,合成塔内温度不变,而塔内气体压强降低到原来的2/5。通过计算说明这时有无汽油生成。
(3)要达到上述合成汽油的要求,CO和H2的体积比的取值范围是多少?
某烃A分子式是C1 398H1 278,它由4种基团组成,这4种基团分别是 (3价)
(3价) (2价);
(2价); (2价);(CH3)3C—(1价)
(2价);(CH3)3C—(1价)
已知,该分子结构中没有苯环连接苯环、炔键连接炔键的情况,试求A分子中含有这4种基团各几个?
在沥青中存在一系列结构相似的稠环芳香烃。这一系列化合物中的前三个同系物的结构简式如右图所示。
(1)萘的分子式是______________,芘的分子式是______________,蒽并蒽的分子式是______________。
(2)上述一系列化合物中,相邻两化合物分子式之差为CnHm,则n值为______________,m值为______________。
(3)这一系列有机物的通式可用含x的代数式来表示(x为自然数1,2,3,4…),则该通式为______________。
(4)随着x值的增大,这一系列化合物含碳的质量分数的极限数值为______________。